Regra do Octeto (Enem 2019)
2 participantes
Página 1 de 1
 Regra do Octeto (Enem 2019)
Regra do Octeto (Enem 2019)
Questão:
Por terem camada de valência completa, alta energia de ionização e afinidade eletrônica praticamente nula, considerou-se por muito tempo que os gases nobres não formariam compostos químicos. Porém, em 1962, foi realizada com sucesso a reação entre o xenônio (camada de valência 5s25p6) e o hexafluoreto de platina e, desde então, mais compostos novos de gases nobres vêm sendo sintetizados. Tais compostos demonstram que não se pode aceitar acriticamente a regra do octeto, na qual se considera que, numa ligação química, os átomos tendem a adquirir estabilidade assumindo a configuração eletrônica de gás nobre. Dentre os compostos conhecidos, um dos mais estáveis é o difluoreto de xenônio, no qual dois átomos do halogênio flúor (camada de valência 2s22p5) se ligam covalentemente ao átomo de gás nobre para ficarem com oito elétrons de valência.
Ao se escrever a fórmula de Lewis do composto de xenônio citado, quantos elétrons na camada de valência haverá no átomo do gás nobre?
a) 6
b) 8
c) 10
d) 12
e) 14
Dúvida: O gabarito da questão afirma que a resposta correta é a opção (c) 10. Contudo, não entendo como o xenônio não faz uma ligação covalente dativa, já que pelo o que sei, seria completamente possível, e uma melhor alternativa do que ficar com 10 elétrons na camada de valência. Em outras palavras, o que impede o xenônio de fazer uma ligação covalente dativa (como o SO2), de modo que todos os elementos fiquem com 8 elétrons na camada de valência?
Por terem camada de valência completa, alta energia de ionização e afinidade eletrônica praticamente nula, considerou-se por muito tempo que os gases nobres não formariam compostos químicos. Porém, em 1962, foi realizada com sucesso a reação entre o xenônio (camada de valência 5s25p6) e o hexafluoreto de platina e, desde então, mais compostos novos de gases nobres vêm sendo sintetizados. Tais compostos demonstram que não se pode aceitar acriticamente a regra do octeto, na qual se considera que, numa ligação química, os átomos tendem a adquirir estabilidade assumindo a configuração eletrônica de gás nobre. Dentre os compostos conhecidos, um dos mais estáveis é o difluoreto de xenônio, no qual dois átomos do halogênio flúor (camada de valência 2s22p5) se ligam covalentemente ao átomo de gás nobre para ficarem com oito elétrons de valência.
Ao se escrever a fórmula de Lewis do composto de xenônio citado, quantos elétrons na camada de valência haverá no átomo do gás nobre?
a) 6
b) 8
c) 10
d) 12
e) 14
Dúvida: O gabarito da questão afirma que a resposta correta é a opção (c) 10. Contudo, não entendo como o xenônio não faz uma ligação covalente dativa, já que pelo o que sei, seria completamente possível, e uma melhor alternativa do que ficar com 10 elétrons na camada de valência. Em outras palavras, o que impede o xenônio de fazer uma ligação covalente dativa (como o SO2), de modo que todos os elementos fiquem com 8 elétrons na camada de valência?
Lucas4lmeida- Iniciante
- Mensagens : 37
Data de inscrição : 21/05/2020
 Re: Regra do Octeto (Enem 2019)
Re: Regra do Octeto (Enem 2019)
Vamos montar a estrutura de Lewis, passo a passo.
Total de elétrons de valência: 2x7+8=22 elétrons.
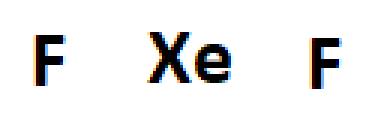
Primeiro: vamos completar os orbitais híbridos;
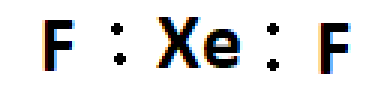
Agora, temos 18 elétrons, vamos completar os orbitais não híbridos dos dois Flúor;
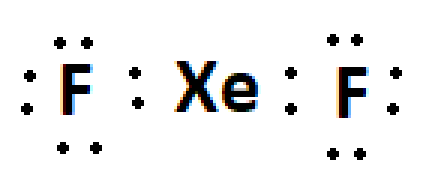
Usamos 16 elétrons, ainda restam 6, note que o Xe possui orbitais incompletos, vamos completar;
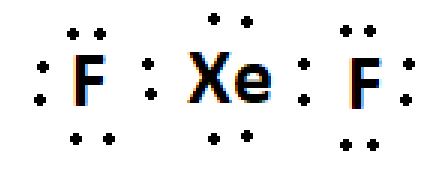
Nesse ponto os flúor tem orbitais da camada 2 completos, assim como o xenônio tem orbitais da camada 5 completos. Mas ainda temos 2 elétrons para distribuir. Temos 2 opções, ou esses 2 elétrons são colocados em um orbital s de camada 3 do flúor ou no orbital s de camada 6 do xenônio. O que é mais estável? Com toda certeza esse par deve ir para o Xe, visto que o flúor é EXTREMAMENTE eletronegativo, ele não vai aceitar esses elétrons de modo algum, então, usamos menos energia para inserir esse par em uma nova camada do Xe. Cheque as cargas formais, esse composto de carga formal 0, o que implica grande estabilidade.

O que você sugeriu seria isso:
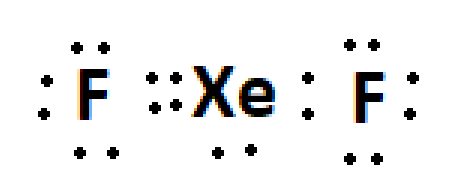
certo?
Essa configuração implica apenas 20 elétrons de valência, em vez dos 22, temos Xe + 2F, se você montar um composto com 20 elétrons ele com certeza não será neutro.
Primeira regra para montar a estrutura de Lewis: deve-se respeitar o total de elétrons que a molécula possui, pois a formação do composto é a partir dos átomos, não de íons, para o composto formar a dativa dessa forma teríamos que reagir o Xe com dois ânions flúor.
Mas, a carga formal do composto com a dativa tem uma carga formal bem diferente de zero, o que sugere que esse composto não existe.
Total de elétrons de valência: 2x7+8=22 elétrons.
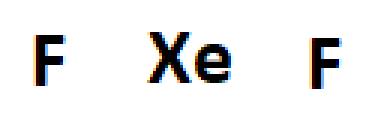
Primeiro: vamos completar os orbitais híbridos;
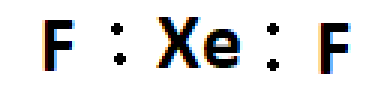
Agora, temos 18 elétrons, vamos completar os orbitais não híbridos dos dois Flúor;
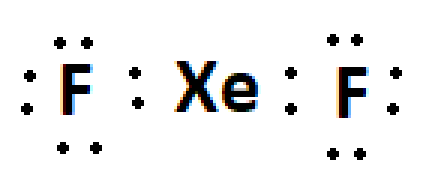
Usamos 16 elétrons, ainda restam 6, note que o Xe possui orbitais incompletos, vamos completar;
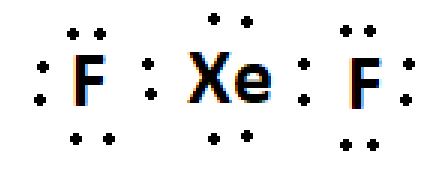
Nesse ponto os flúor tem orbitais da camada 2 completos, assim como o xenônio tem orbitais da camada 5 completos. Mas ainda temos 2 elétrons para distribuir. Temos 2 opções, ou esses 2 elétrons são colocados em um orbital s de camada 3 do flúor ou no orbital s de camada 6 do xenônio. O que é mais estável? Com toda certeza esse par deve ir para o Xe, visto que o flúor é EXTREMAMENTE eletronegativo, ele não vai aceitar esses elétrons de modo algum, então, usamos menos energia para inserir esse par em uma nova camada do Xe. Cheque as cargas formais, esse composto de carga formal 0, o que implica grande estabilidade.

O que você sugeriu seria isso:
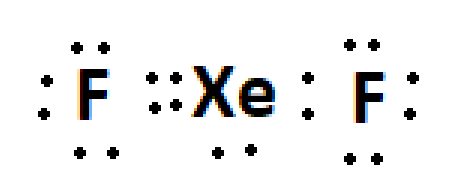
certo?
Essa configuração implica apenas 20 elétrons de valência, em vez dos 22, temos Xe + 2F, se você montar um composto com 20 elétrons ele com certeza não será neutro.
Primeira regra para montar a estrutura de Lewis: deve-se respeitar o total de elétrons que a molécula possui, pois a formação do composto é a partir dos átomos, não de íons, para o composto formar a dativa dessa forma teríamos que reagir o Xe com dois ânions flúor.
Mas, a carga formal do composto com a dativa tem uma carga formal bem diferente de zero, o que sugere que esse composto não existe.
____________________________________________
El Álgebra no es más que Geometría y la Geometría no es más que Álgebra abstracta
Sophie Germain
Sophie Germain
Emanuel Dias- Monitor

- Mensagens : 1703
Data de inscrição : 15/12/2018
Idade : 22
Localização : São Paulo
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|













