Lei de Velocidade
2 participantes
Página 1 de 1
 Lei de Velocidade
Lei de Velocidade
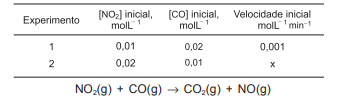
A Lei da velocidade de uma reação química é determinada, experimentalmente, porque, em geral, as reações ocorrem em duas ou mais etapas, e não diretamente como sugere a equação química. A reação química entre NO2(g) e CO(g) não é elementar, portanto ocorre em mais de uma etapa e tem Lei de velocidade representada pela expressão
A) A velocidade da reação representada por x na tabela é igual a 4,0.10−3 molL−1 min−1 .
B) O valor numérico da constante de velocidade, k, de reação é igual a 1,0mol−1 Lmin−1 .
C) A velocidade de reação se torna o dobro da inicial, ao se duplicar a concentração de NO2(g).
D) A etapa lenta da reação ocorre por meio da colisão entre uma molécula de NO2(g) e uma molécula de CO(g).
E) A molecularidade de uma reação química representa o número máximo de moléculas que colidem em cada reação elementar.
- Resposta :
- A
Tentei resolver mas não consegui...
Gostaria muito se possível a resolução das alternativas...
Muito Obrigada!!!
Última edição por ccclarat em Seg 10 Set 2018, 16:35, editado 1 vez(es)

ccclarat- Recebeu o sabre de luz

- Mensagens : 107
Data de inscrição : 30/08/2018
Idade : 31
Localização : Sao Paulo, Sao Paulo
 Re: Lei de Velocidade
Re: Lei de Velocidade
Oi, tudo bem? Então eu consegui chegar na resposta assim:
v = k [NO2]² --(usando os dados do experimento 1)--> 10^-3 = k.(10^-2)² --> k = 10
a) v = 10.(2.10^-2)² --> v = 10.2².10^-4 --> 4.10^-3 mol/L.min --> correta
b) k = 10 --> errada
c) Incorreta, a velocidade quadruplicou ao dobrar a concentração
d) Meu pensamento, fazendo a questão durante a prova, é que essa seja a etapa rápida devido a instabilidade do monóxido de carbono. Eu achei a reação que ocorre e é essa daqui:
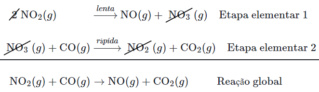
e) Desculpe-me mas não me lembro o que é molecularidade, em uma breve pesquisa achei o seguinte "A molecularidade representa o número mínimo de moléculas ou íons reagentes necessários para que ocorram colisões e a reação possa se processar em uma única etapa".
Desculpe-me por não poder explicar concretamente a letra E, mas caso tenha mais alguma dúvida, é só falar!
v = k [NO2]² --(usando os dados do experimento 1)--> 10^-3 = k.(10^-2)² --> k = 10
a) v = 10.(2.10^-2)² --> v = 10.2².10^-4 --> 4.10^-3 mol/L.min --> correta
b) k = 10 --> errada
c) Incorreta, a velocidade quadruplicou ao dobrar a concentração
d) Meu pensamento, fazendo a questão durante a prova, é que essa seja a etapa rápida devido a instabilidade do monóxido de carbono. Eu achei a reação que ocorre e é essa daqui:
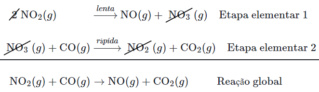
e) Desculpe-me mas não me lembro o que é molecularidade, em uma breve pesquisa achei o seguinte "A molecularidade representa o número mínimo de moléculas ou íons reagentes necessários para que ocorram colisões e a reação possa se processar em uma única etapa".
Desculpe-me por não poder explicar concretamente a letra E, mas caso tenha mais alguma dúvida, é só falar!
VesTeles- Mestre Jedi

- Mensagens : 609
Data de inscrição : 14/04/2017
Idade : 23
Localização : São Paulo
 Tópicos semelhantes
Tópicos semelhantes» Lei da Velocidade, Velocidade da reação e Expressão da Constante
» Velocidade de escape e velocidade de orbita
» Velocidade Angular - Velocidade Média
» Velocidade resultante e Velocidade Relativa
» Velocidade da luz e velocidade da fonte
» Velocidade de escape e velocidade de orbita
» Velocidade Angular - Velocidade Média
» Velocidade resultante e Velocidade Relativa
» Velocidade da luz e velocidade da fonte
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|













