Queima de etano
4 participantes
Página 1 de 1
 Queima de etano
Queima de etano
Em um recipiente fechado queima-se etano com 80% da quantidade estequiométrica de ar. Admitindo que não haja hidrocarbonetos após a combustão que todos os produtos da reação estejam na fase gasosa e que a composição volumétrica do ar seja de uma partícula de gás oxigênio para cada quatro partículas de gás nitrogênio, qual a fração molar de vapor de água na mistura gasosa após a combustão?
- resp.:
- 18,5%

Ashitaka- Monitor

- Mensagens : 4365
Data de inscrição : 12/03/2013
Localização : São Paulo
 Re: Queima de etano
Re: Queima de etano
Reação de combustão completa
C2H6 + 7/2 O2 --> 2 CO2 + 3 H2O
nO2 = 0,8*3,5 = 2,8 .:. nN2 = 2,8*4 = 11,2
Reação incompleta
C2H6 + 2,8O2 + 11,2N2 --> 0,6CO2 + 1,4CO + 3H2O + 11,2N2
OBS: N2 não participa da reação, e sabemos que não há formação de C, pois os produtos estão todos no estado gasoso.
XH2O = nH2O/ntotal = 3/16,2 = 0,18518* 100 = 18,518
C2H6 + 7/2 O2 --> 2 CO2 + 3 H2O
nO2 = 0,8*3,5 = 2,8 .:. nN2 = 2,8*4 = 11,2
Reação incompleta
C2H6 + 2,8O2 + 11,2N2 --> 0,6CO2 + 1,4CO + 3H2O + 11,2N2
OBS: N2 não participa da reação, e sabemos que não há formação de C, pois os produtos estão todos no estado gasoso.
XH2O = nH2O/ntotal = 3/16,2 = 0,18518* 100 = 18,518
Aeron945- Mestre Jedi

- Mensagens : 755
Data de inscrição : 27/02/2015
Idade : 29
Localização : Bauru, SP
 Re: Queima de etano
Re: Queima de etano
Não entendi algumas coisas. Primeiramente, o que quer dizer com "80% da quantidade estequiométrica de ar"? Significa que só terei 80% do oxigênio necessário para combustão completa? Se sim, como poderia deduzir que isso a partir da frase dita? Não consigo ver relação entre as coisas.

Ashitaka- Monitor

- Mensagens : 4365
Data de inscrição : 12/03/2013
Localização : São Paulo
 Re: Queima de etano
Re: Queima de etano
"queima-se etano com 80% da quantidade estequiométrica de ar".
O etano reagem com 80% da quantidade ESTEQUIOMÉTRICA de O2, ou seja, (80/100)*(7/2) que é a quantidade estequiométrica de O2, mas para isso ocorrer é porque a combustão foi incompleta. Quando ele diz quantidade estequiométrica de ar ele está se referindo ao oxigênio, visto que o N2 não participa da reação de combustão, mas eu o coloquei na reação pois, apesar de não participar da reação, o N2 está presente no ar. Ficou claro, ou eu não consegui explicar muito bem?
O etano reagem com 80% da quantidade ESTEQUIOMÉTRICA de O2, ou seja, (80/100)*(7/2) que é a quantidade estequiométrica de O2, mas para isso ocorrer é porque a combustão foi incompleta. Quando ele diz quantidade estequiométrica de ar ele está se referindo ao oxigênio, visto que o N2 não participa da reação de combustão, mas eu o coloquei na reação pois, apesar de não participar da reação, o N2 está presente no ar. Ficou claro, ou eu não consegui explicar muito bem?
Aeron945- Mestre Jedi

- Mensagens : 755
Data de inscrição : 27/02/2015
Idade : 29
Localização : Bauru, SP
 Re: Queima de etano
Re: Queima de etano
Os 80% implica que teremos menor quantidade necessária que a necessária para combustão completa de todo o etano.
Pela equação abaixo:
}&space;+&space;\dfrac{7}{2}&space;O_{2(g)}&space;\longrightarrow&space;2CO_{2(g)}&space;+&space;3H_2O_{(g)}&space;})
Seriam necessários 7/2 mols de oxigênio. Contudo, pelo enunciado, temos apenas 80% do necessário, então temos:
}&space;+&space;\dfrac{14}{5}&space;O_{2(g)}&space;\longrightarrow&space;CO_{2(g)}&space;+&space;H_2O_{(g)}&space;\&space;\&space;\&space;\&space;\&space;N\~ao&space;\&space;balanceada})
Assim que balanceamos, temos:
}&space;+&space;14&space;O_{2(g)}&space;\longrightarrow&space;7CO_{(g)}+3CO_{2(g)}&space;+&space;15H_2O_{(g)}&space;})
E assim, a fração total seria:
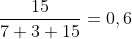
Contudo, temos que há no conjunto, Nitrogênio:
}&space;+&space;14&space;O_{2(g)}&space;+&space;N_{2(g)}&space;\longrightarrow&space;7CO_{(g)}+3CO_{2(g)}&space;+&space;15H_2O_{(g)}&space;+N_{2(g)}&space;\&space;\&space;\&space;\&space;N\~ao&space;\&space;balanceada})
Então, teriamos a equação onde o nitrogênio "apenas observa", e que teremos 4 vezes mais nitrogênio que oxigênio:
}&space;+&space;14&space;O_{2(g)}&space;+&space;56N_{2(g)}&space;\longrightarrow&space;7CO_{(g)}+3CO_{2(g)}&space;+&space;15H_2O_{(g)}&space;+56N_{2(g)}}&space;\\&space;\mathrm{Raz\~ao=\dfrac{15}{7+3+15+56}=\dfrac{5}{27}=&space;0,1\overline{851}})
Pela equação abaixo:
Seriam necessários 7/2 mols de oxigênio. Contudo, pelo enunciado, temos apenas 80% do necessário, então temos:
Assim que balanceamos, temos:
E assim, a fração total seria:
Contudo, temos que há no conjunto, Nitrogênio:
Então, teriamos a equação onde o nitrogênio "apenas observa", e que teremos 4 vezes mais nitrogênio que oxigênio:
____________________________________________
← → ↛  ⇌ ⇔ ⇐ ⇒ ⇏ ➥
⇌ ⇔ ⇐ ⇒ ⇏ ➥
 ⇌ ⇔ ⇐ ⇒ ⇏ ➥
⇌ ⇔ ⇐ ⇒ ⇏ ➥⁰ ¹ ² ³ ⁴ ⁵ ⁶ ⁷ ⁸ ⁹ ⁺ ⁻ ⁼ ⁽ ⁾ º ª ⁿ ⁱ
₀ ₁ ₂ ₃ ₄ ₅ ₆ ₇ ₈ ₉ ₊ ₋ ₌ ₍ ₎ ₐ ₑ ₒ ₓ ₔ
∴ ≈ ≠ ≡ ≢ ≤ ≥ × ± ∓ ∑ ∏ √ ∛ ∜ ∝ ∞
∀ ∃ ∈ ∉ ⊂ ⊄ ⋂ ⋃ ∧ ∨ ℝ ℕ ℚ ℤ ℂ
⊥ ║ ∡ ∠ ∢ ⊿ △ □ ▭ ◊ ○ ∆ ◦ ⊙ ⊗ ◈
Αα Ββ Γγ Δδ Εε Ζζ Ηη Θθ Ιι Κκ Λλ Μμ Νν Ξξ Οο Ππ Ρρ Σσς Ττ Υυ Φφ Χχ Ψψ Ωω ϑ ϒ ϖ ƒ ij ℓ
∫ ∬ ∭ ∳ ∂ ∇
 ℛ ℜ ℰ ℳ ℊ ℒ
ℛ ℜ ℰ ℳ ℊ ℒ
Carlos Adir- Monitor

- Mensagens : 2820
Data de inscrição : 27/08/2014
Idade : 28
Localização : Gurupi - TO - Brasil
 Re: Queima de etano
Re: Queima de etano
Agora entendi. Muito obrigado Carlos e Aeron. Poxa, eu tenho um grande problema com enunciados de química. Pra mim, eles quase sempre parecem ambíguos ou incompletos (e isso parece ocorrer com grande frequência, principalmente em questões do IME, na minha opinião). Por ar eu entendo nitrogênio + oxigênio. Acho que é infeliz dizer 80% de ar em vez de 80% de oxigênio. Pensei até em fazer 80% * % de O2 no ar, mas logo pensei que provavelmente não era isso. Se tiverem alguma dica no sentido de interpretação de enunciados do tipo (o que acho difícil), agradeceria se compartilhassem. 
Além disso, gostaria que olhassem essa questão, se possível:
https://pir2.forumeiros.com/t88100-queima-de-alcano
Mais uma vez, muito obrigado aos dois.
Além disso, gostaria que olhassem essa questão, se possível:
https://pir2.forumeiros.com/t88100-queima-de-alcano
Mais uma vez, muito obrigado aos dois.

Ashitaka- Monitor

- Mensagens : 4365
Data de inscrição : 12/03/2013
Localização : São Paulo
 Re: Queima de etano
Re: Queima de etano
Ashitaka, não sei se fica mais claro, mas quando ele diz que o etano reage com 80% da quantidade estequiométrica de ar, o que eu faria seria escrever a reação com o ar nos reagentes, veja essa questão:
https://pir2.forumeiros.com/t83536-ita-equacoes-quimicas
Ao saber a quantidade estequiométrica do ar, obtemos a que tem 80% dela.
e desses 80% da quantidade estequiométrica, x é oxigênio e 4x é nitrogênio e então obteremos os mesmos valores muito bem apresentado pelos nossos colegas.
https://pir2.forumeiros.com/t83536-ita-equacoes-quimicas
Ao saber a quantidade estequiométrica do ar, obtemos a que tem 80% dela.
e desses 80% da quantidade estequiométrica, x é oxigênio e 4x é nitrogênio e então obteremos os mesmos valores muito bem apresentado pelos nossos colegas.
____________________________________________
Thálisson.

Thálisson C- Monitor

- Mensagens : 3020
Data de inscrição : 19/02/2014
Idade : 27
Localização : Gurupi -TO
 Re: Queima de etano
Re: Queima de etano
Então foi uma coincidência dar certo pegando 80% diretamente da quantidade de O2?
No original:
Pegamos 80% do ar: 5(a+b/4) = 4a + b e 20% disso é O2:
O2 = (4a+b)/5 = (4*2+6)/5 = 2,8 mols.
Daí nota-se que foi tirado 80% da quantidade de ar e depois 80% desses 20%, que se referem a quantidade de O2 presente nesses 80%.
Numa outra versão, suponha que reage com 40% da quantidade estequiométrica de ar:
Pegamos 40% do ar: 5(a+b/4) = 2a + b/2 e 20% do ar é O2:
O2 = (2a + b/2)/5 = (4+3)/5 = 1,4 mols.
Parece que foi coincidência dar certo tirar 80% direto do coeficiente estequiométrico da combustão completa. O que acha? Se eu estiver fazendo burrada, avise, estou com sono hahahahhaa
No original:
Pegamos 80% do ar: 5(a+b/4) = 4a + b e 20% disso é O2:
O2 = (4a+b)/5 = (4*2+6)/5 = 2,8 mols.
Daí nota-se que foi tirado 80% da quantidade de ar e depois 80% desses 20%, que se referem a quantidade de O2 presente nesses 80%.
Numa outra versão, suponha que reage com 40% da quantidade estequiométrica de ar:
Pegamos 40% do ar: 5(a+b/4) = 2a + b/2 e 20% do ar é O2:
O2 = (2a + b/2)/5 = (4+3)/5 = 1,4 mols.
Parece que foi coincidência dar certo tirar 80% direto do coeficiente estequiométrico da combustão completa. O que acha? Se eu estiver fazendo burrada, avise, estou com sono hahahahhaa

Ashitaka- Monitor

- Mensagens : 4365
Data de inscrição : 12/03/2013
Localização : São Paulo
 Re: Queima de etano
Re: Queima de etano
Não foi coincidência, haha
Como já haviam tirado a porcentagem de oxigênio em 80% da quantidade de ar, achar a do nitrogênio é só multiplicar por 4.
Realmente do primeiro modo parece mais indireto (proposto pelos cursinhos).. mas dá na mesma, a única diferença é que conceitualmente ficamos mais convencidos.
Como já haviam tirado a porcentagem de oxigênio em 80% da quantidade de ar, achar a do nitrogênio é só multiplicar por 4.
Realmente do primeiro modo parece mais indireto (proposto pelos cursinhos).. mas dá na mesma, a única diferença é que conceitualmente ficamos mais convencidos.
____________________________________________
Thálisson.

Thálisson C- Monitor

- Mensagens : 3020
Data de inscrição : 19/02/2014
Idade : 27
Localização : Gurupi -TO
 Re: Queima de etano
Re: Queima de etano
Você está certo, eu viajei aqui. Thanks.

Ashitaka- Monitor

- Mensagens : 4365
Data de inscrição : 12/03/2013
Localização : São Paulo
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












