lei de proust e lavoisier
3 participantes
Página 1 de 1
 lei de proust e lavoisier
lei de proust e lavoisier
Devido à toxicidade do mercúrio, em caso de derramamento desse metal, costuma-se espalhar enxofre no local, para removê-lo. Mercúrio e enxofre reagem, gradativamente, formando sulfeto de mercúrio. Para fins de estudo, a reação pode ocorrer mais rapidamente se as duas substâncias forem misturadas num almofariz. Usando esse procedimento, foram feitos dois experimentos. No primeiro, 5,0 g de mercúrio e 1,0 g de enxofre reagiram, formando 5,8 g do produto, sobrando 0,2 g de enxofre. No segundo experimento, 12,0 g de mercúrio e 1,6 g de enxofre forneceram 11,6 g do produto, restando 2,0 g de mercúrio.
A ) Existem compostos de Hg (I) e de Hg (II). Considerando os valores das massas molares e das massas envolvidas nos dois experimentos citados, verifique se a fórmula do composto formado, em ambos os casos, é HgS ou Hg2S. Mostre os cálculos.
alguém poderia me ajudar nesse exercício..como faço p descobrir quais dos sulfetos de mercúrio é ?
A ) Existem compostos de Hg (I) e de Hg (II). Considerando os valores das massas molares e das massas envolvidas nos dois experimentos citados, verifique se a fórmula do composto formado, em ambos os casos, é HgS ou Hg2S. Mostre os cálculos.
alguém poderia me ajudar nesse exercício..como faço p descobrir quais dos sulfetos de mercúrio é ?

jumentaoo- Jedi

- Mensagens : 236
Data de inscrição : 29/03/2015
Idade : 25
Localização : marília , são paulo , brasil
 Re: lei de proust e lavoisier
Re: lei de proust e lavoisier
E aí, jumentaoo. Vamos pra mais uma questão.
Para o primeiro experimento:
32-----232,5
x------5,8
Observamos que 0,8g de S reagiram, portanto, sobraram 0,2 (tínhamos 1,0g, reagiram 0,8. 1,0-0,8=0,2). Como o resultado está de acordo com o enunciado, sabemos que a reação que ocorreu no primeiro experimento foi a supracitada.
- Tá... mas não entendi ainda, Chries.
Simples. Tu perguntou como tu iria descobrir qual dos dois sulfetos é, certo? Se o sulfeto formado fosse o 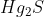 , o valor "232,5" na regra de três ia ser outro, pois somaria mais 200,5. Aí, quando tu realizasses a regra de três, o resultado não seria 0,8. Portanto, do valor de S que possuíamos (1,0g) iria sobrar menos que 0,2g. Iria sobrar, na verdade, 0,1g, e não é isso o que o enunciado afirma, dando-nos, então, a certeza de que a reação que ocorreu foi a que eu expus aí em cima.
, o valor "232,5" na regra de três ia ser outro, pois somaria mais 200,5. Aí, quando tu realizasses a regra de três, o resultado não seria 0,8. Portanto, do valor de S que possuíamos (1,0g) iria sobrar menos que 0,2g. Iria sobrar, na verdade, 0,1g, e não é isso o que o enunciado afirma, dando-nos, então, a certeza de que a reação que ocorreu foi a que eu expus aí em cima.
Vamos agora para o segundo experimento:
32----------232,5
1,6---------------y
Novamente, a reação que ocorre é a do ) , pelo mesmo motivo do outro experimento. Repare que desta vez eu utilizei outra regra de três, utilizando, na verdade, o S como valor conhecido e o HgS como valor desconhecido. Por que eu não usei o Hg como valor conhecido? Porque se eu realizasse a regra de três com o valor da massa molar de Hg2S (supondo que acontecesse a outra reação anunciada pela questão), a massa molar de Hg ia variar proporcionalmente, para 2Hg, e o resultado ia acabar sendo o mesmo, pois as duas massas variaram proporcionalmente.
, pelo mesmo motivo do outro experimento. Repare que desta vez eu utilizei outra regra de três, utilizando, na verdade, o S como valor conhecido e o HgS como valor desconhecido. Por que eu não usei o Hg como valor conhecido? Porque se eu realizasse a regra de três com o valor da massa molar de Hg2S (supondo que acontecesse a outra reação anunciada pela questão), a massa molar de Hg ia variar proporcionalmente, para 2Hg, e o resultado ia acabar sendo o mesmo, pois as duas massas variaram proporcionalmente.
Última edição por Chries em Ter 14 Abr 2015, 19:43, editado 2 vez(es)
 Re: lei de proust e lavoisier
Re: lei de proust e lavoisier
chries , valeu.. entendi agora !! obrigado por me salvar..está ajudando muito !

jumentaoo- Jedi

- Mensagens : 236
Data de inscrição : 29/03/2015
Idade : 25
Localização : marília , são paulo , brasil
 Re: lei de proust e lavoisier
Re: lei de proust e lavoisier
Peço para que dês mais uma lida na explicação do segundo experimento. Eu tinha cometido um erro, pois estava com pressa.
Se eu utilizasse o valor de Hg pra regra de três, como eu tinha usado na outra explicação, a regra de três pras duas reações possíveis (formando Hg2S e HgS) iam dar o mesmo resultado pra quantia de Hg presente, pois a massa de Hg iria variar proporcionalmente com a massa de HgS (Hg se tornaria 2Hg, dobrando seu valor, e HgS se tornaria Hg2S, praticamente dobrando seu valor também), tornando, portanto, a resposta duvidosa.
Com essa explicação que coloquei agora ficou mais certinho.
A resposta continua sendo a mesma, só o motivo se tornou outro.
Foi mal pela confusão aí.
Se eu utilizasse o valor de Hg pra regra de três, como eu tinha usado na outra explicação, a regra de três pras duas reações possíveis (formando Hg2S e HgS) iam dar o mesmo resultado pra quantia de Hg presente, pois a massa de Hg iria variar proporcionalmente com a massa de HgS (Hg se tornaria 2Hg, dobrando seu valor, e HgS se tornaria Hg2S, praticamente dobrando seu valor também), tornando, portanto, a resposta duvidosa.
Com essa explicação que coloquei agora ficou mais certinho.
A resposta continua sendo a mesma, só o motivo se tornou outro.
Foi mal pela confusão aí.
 Re: lei de proust e lavoisier
Re: lei de proust e lavoisier
Lei de Proporções Constantes - Leis da Estequiometria
Geral :
Se você observar reações químicas ou conversões, existem algumas leis que ajudam a resolver problemas no campo das transformações metabólicas. As leis mais importantes são:
- Lei para a conservação da massa
- Lei de proporções constantes
- Lei de múltiplas proporções
A Lei das Proporções Constantes ou Leis das Massas Constantes :
A Lei das Proporções Constantes afirma que em um composto os elementos individuais estão sempre contidos em uma determinada proporção, isto é, em reações químicas os elementos e compostos reagem em proporções bastante específicas ( por exemplo, 2 átomos de hidrogênio e 1 átomo de oxigênio à água).
(Também chamada de lei de rácios de massa constante) A lei de proporções definidas é devido a Joseph-Louis Proust, que postulado forma que um composto químico é (contido no composto) a partir dos elementos em uma característica muito específica para eles proporção em massa.
Nota 1:
A lei de proporções constantes afirma que certas proporções de massa de diferentes elementos sempre reagem umas com as outras a um produto específico. Isso pode ser ilustrado pelo exemplo do carbono e do oxigênio, uma vez que o carbono e o oxigênio podem reagir para formar vários produtos, por exemplo, o monóxido de carbono e o dióxido de carbono. Portanto, nunca se pode dizer que dois ou mais elementos reagem em uma quantidade ou razão de massa bem definida ao produto. É verdade que os elementos de partida que reagem a um determinado produto sempre têm um específico Relação de massa entre si. Por exemplo, a proporção de massa em cloreto de sódio (NaCl) é sempre de 39% de sódio para 61% de cloro, não importa de onde venha o cloreto de sódio.
Qual é o significado dessa lei?
A lei diz que um composto particular sempre tem uma fórmula de soma igual e definitiva (elementos individuais estão sempre contidos em uma determinada proporção) em todo o mundo.
Nota 2 :
Embora existam também compostos (especialmente no campo da química do estado sólido) onde as proporções de massa dos elementos no composto podem variar (estes compostos são chamados de não daltonides ou compostos de berthollide). Os compostos de berthollide (isto é nenhum daltonides, isto é compostos em que os elementos não são todos em proporções constantes um ao outro) são principalmente misturado cristais, ligas e polímeros.
odanielpereira@gmail.com- Iniciante
- Mensagens : 4
Data de inscrição : 07/11/2017
Idade : 46
Localização : são paulo, são paulo brasil
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|














