(UFSM) Ligações intermoleculares - Ponte de hidrogênio
3 participantes
Página 1 de 1
 (UFSM) Ligações intermoleculares - Ponte de hidrogênio
(UFSM) Ligações intermoleculares - Ponte de hidrogênio
(UFSM) O gel usado nos pacientes durante o exame de ultra-som é um polímero do ácido acrílico que tem a estrutura:
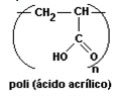
Entre as cadeias, há formação de ligações de hidrogênio, nas quais átomos de hidrogênio se ligam a átomos de oxigênio mais .......... da outra cadeia, produzindo interações .......... que .......... a força de coesão, levando à formação do gel.
a) eletropositivos - fortes - aumentam
b) eletronegativos - fracas - diminuem
c) eletronegativos - fortes - diminuem
d) eletropositivos - fracas - aumentam
e) eletronegativos - fracas - aumentam
R: Letra E
Dúvida:
Como as ligações de hidrogênio são as mais fortes das forças intermoleculares, não teria que ser "...produzindo interações mais FORTES que AUMENTAM a força de coesão..."?

Entre as cadeias, há formação de ligações de hidrogênio, nas quais átomos de hidrogênio se ligam a átomos de oxigênio mais .......... da outra cadeia, produzindo interações .......... que .......... a força de coesão, levando à formação do gel.
a) eletropositivos - fortes - aumentam
b) eletronegativos - fracas - diminuem
c) eletronegativos - fortes - diminuem
d) eletropositivos - fracas - aumentam
e) eletronegativos - fracas - aumentam
R: Letra E
Dúvida:
Como as ligações de hidrogênio são as mais fortes das forças intermoleculares, não teria que ser "...produzindo interações mais FORTES que AUMENTAM a força de coesão..."?
henriquehdias- Jedi

- Mensagens : 303
Data de inscrição : 19/03/2012
Idade : 33
Localização : Ijuí
 Re: (UFSM) Ligações intermoleculares - Ponte de hidrogênio
Re: (UFSM) Ligações intermoleculares - Ponte de hidrogênio
Elas são as mais fortes entre as moléculas, mas são mais fracas que as interatômicas, as ligações químicas e, por isso, podem ser rompidas por processos físicos.
rihan- Estrela Dourada

- Mensagens : 5049
Data de inscrição : 22/08/2011
Idade : 69
Localização : Rio de Janeiro, RJ, Itabuna-Ilhéus, BA, Brasil
 Re: (UFSM) Ligações intermoleculares - Ponte de hidrogênio
Re: (UFSM) Ligações intermoleculares - Ponte de hidrogênio
Ligações entre os átomos são as mais fortes.
Ligações entre as moléculas são mais fracas e podem ser rompidas facilmente.
Porém eu achei que nesse caso teria uma interação forte que aumentasse a coesão. Ou então eu interpretei erradp a questão, mas mesmo assim cheguei na resposta certa. No entanto, se tivesse a opção "eletronegativos - fortes - aumentam", eu teria marcado e errado a questão.
Ligações entre as moléculas são mais fracas e podem ser rompidas facilmente.
Porém eu achei que nesse caso teria uma interação forte que aumentasse a coesão. Ou então eu interpretei erradp a questão, mas mesmo assim cheguei na resposta certa. No entanto, se tivesse a opção "eletronegativos - fortes - aumentam", eu teria marcado e errado a questão.
henriquehdias- Jedi

- Mensagens : 303
Data de inscrição : 19/03/2012
Idade : 33
Localização : Ijuí
 Re: (UFSM) Ligações intermoleculares - Ponte de hidrogênio
Re: (UFSM) Ligações intermoleculares - Ponte de hidrogênio
Forte e Fraco são relativos...
O que importa é que EXISTE MAIS UMA FORÇA, aumentando a força necessária para rompê-las.
Pode ser uma força forte ou fraca, que vai aumentar a coesão entre as moléculas.
A questão é CAPCIOSA E MAL FORMULADA MESMO !
Quando se diz FORTE/FRACO temos sempre que dizer em relação a quem ou a que.
Mas não se espante, mesmo ...
No Brasil há mais de 70% de pessoas que não sabem escrever ou ler !
!
O que importa é que EXISTE MAIS UMA FORÇA, aumentando a força necessária para rompê-las.
Pode ser uma força forte ou fraca, que vai aumentar a coesão entre as moléculas.
A questão é CAPCIOSA E MAL FORMULADA MESMO !
Quando se diz FORTE/FRACO temos sempre que dizer em relação a quem ou a que.
Mas não se espante, mesmo ...
No Brasil há mais de 70% de pessoas que não sabem escrever ou ler
 !
!
rihan- Estrela Dourada

- Mensagens : 5049
Data de inscrição : 22/08/2011
Idade : 69
Localização : Rio de Janeiro, RJ, Itabuna-Ilhéus, BA, Brasil
 Re: (UFSM) Ligações intermoleculares - Ponte de hidrogênio
Re: (UFSM) Ligações intermoleculares - Ponte de hidrogênio
Show, mestre rihan !! O senhor poderia explicar qual das ligações interatômicas é a mais forte e por que é mais forte ? Sempre fico em dúvida se é a iônica, ou a covalente, ou a metálica... :scratch:
O referencial é entre as próprias ligações interatômicas.
O referencial é entre as próprias ligações interatômicas.
![[Planck]³](https://2img.net/u/2713/85/25/58/avatars/19563-97.jpg)
[Planck]³- Fera

- Mensagens : 673
Data de inscrição : 11/02/2012
Idade : 31
Localização : Mossoró-RN
 Re: (UFSM) Ligações intermoleculares - Ponte de hidrogênio
Re: (UFSM) Ligações intermoleculares - Ponte de hidrogênio
Acho um bom resumo o texto Wikipedia em Inglês:
http://en.wikipedia.org/wiki/Chemical_bond
http://en.wikipedia.org/wiki/Chemical_bond
rihan- Estrela Dourada

- Mensagens : 5049
Data de inscrição : 22/08/2011
Idade : 69
Localização : Rio de Janeiro, RJ, Itabuna-Ilhéus, BA, Brasil
 Re: (UFSM) Ligações intermoleculares - Ponte de hidrogênio
Re: (UFSM) Ligações intermoleculares - Ponte de hidrogênio
Thank you, master! And here we go !!! 
![[Planck]³](https://2img.net/u/2713/85/25/58/avatars/19563-97.jpg)
[Planck]³- Fera

- Mensagens : 673
Data de inscrição : 11/02/2012
Idade : 31
Localização : Mossoró-RN
rihan- Estrela Dourada

- Mensagens : 5049
Data de inscrição : 22/08/2011
Idade : 69
Localização : Rio de Janeiro, RJ, Itabuna-Ilhéus, BA, Brasil
 Re: (UFSM) Ligações intermoleculares - Ponte de hidrogênio
Re: (UFSM) Ligações intermoleculares - Ponte de hidrogênio
A ligação iônica é a mais forte porque tem grande diferença de eletronegatividade entre os átomos ligantes.
henriquehdias- Jedi

- Mensagens : 303
Data de inscrição : 19/03/2012
Idade : 33
Localização : Ijuí
 Re: (UFSM) Ligações intermoleculares - Ponte de hidrogênio
Re: (UFSM) Ligações intermoleculares - Ponte de hidrogênio
Boa !  !
!
Mandou bem Henrique ! !
!
É isso aí !
VIA DE REGRA temos:
Interatômicas:
IÔNICA > METÁLICA > COVALENTE > Intermoleculares (Forças de Van der Waals)
Intermoleculares (Forças de Van der Waals) :
Pontes H > LONDON > Cátion–∏
Relative strength of forces
Note: this comparison is only approximate – the actual relative strengths will vary depending on the molecules involved.
Δ eletronegatividade :
0,0 — 0,3 --> Covalente
0,3 — 1,7 --> Covalente Polar
1,7 — -----> Iônica
MAS :
Tudo isso é uma confusão de autores !
Todos eles, que nem nós, querendo uma regra simples, fácil e única para explicar tudo...
Esperança vã...
Vou fazer um artigo sobre essa bagunça. Em breve.
Já tem 3 na lista de espera...
Mandou bem Henrique !
É isso aí !
VIA DE REGRA temos:
Interatômicas:
IÔNICA > METÁLICA > COVALENTE > Intermoleculares (Forças de Van der Waals)
Intermoleculares (Forças de Van der Waals) :
Pontes H > LONDON > Cátion–∏
Relative strength of forces
| Covalent | 400 |
| Hydrogen bonds | 12–16 |
| Dipole–dipole | 0.5–2 |
| London (van der Waals) Forces | <1 |
Δ eletronegatividade :
0,0 — 0,3 --> Covalente
0,3 — 1,7 --> Covalente Polar
1,7 — -----> Iônica
MAS :
Tudo isso é uma confusão de autores !
Todos eles, que nem nós, querendo uma regra simples, fácil e única para explicar tudo...
Esperança vã...
Vou fazer um artigo sobre essa bagunça. Em breve.
Já tem 3 na lista de espera...
rihan- Estrela Dourada

- Mensagens : 5049
Data de inscrição : 22/08/2011
Idade : 69
Localização : Rio de Janeiro, RJ, Itabuna-Ilhéus, BA, Brasil
 Tópicos semelhantes
Tópicos semelhantes» Ponte de hidrogênio?
» Ponte de hidrogênio
» Ponte de hidrogênio
» Ligações de hidrogênio
» Ligações de hidrogênio
» Ponte de hidrogênio
» Ponte de hidrogênio
» Ligações de hidrogênio
» Ligações de hidrogênio
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












