Conceitos de acidez de compostos orgânicos
2 participantes
PiR2 :: Química :: Química Orgânica
Página 1 de 1
 Conceitos de acidez de compostos orgânicos
Conceitos de acidez de compostos orgânicos
Deparei-me com uma tabela que informa que, em termos de força do ácido (acidez), consta:
ácido sulfônico > ácido carboxílico > fenol > água > álcool
Uma das explicações é que a estrutura de ressonância entre oxigênios dá estabilidade à molécula, o que torna a base conjugada estável e fraca, logo o ácido é forte (+ acidez)
Entretanto, queria saber se essa outra justificativa é viável e se está conceitualmente correta:
A estrutura de ressonância favorece o espalhamento de elétrons, o que diminui a densidade eletrônica e, como consequência, diminui a basicidade. Assim, a base conjugada tem menor força e, portanto, é + estável.
Assim, o ácido é + forte (+acidez) porque a base conjugada é estável, portanto fraca (+ estável).
Obrigado!
ácido sulfônico > ácido carboxílico > fenol > água > álcool
Uma das explicações é que a estrutura de ressonância entre oxigênios dá estabilidade à molécula, o que torna a base conjugada estável e fraca, logo o ácido é forte (+ acidez)
Entretanto, queria saber se essa outra justificativa é viável e se está conceitualmente correta:
A estrutura de ressonância favorece o espalhamento de elétrons, o que diminui a densidade eletrônica e, como consequência, diminui a basicidade. Assim, a base conjugada tem menor força e, portanto, é + estável.
Assim, o ácido é + forte (+acidez) porque a base conjugada é estável, portanto fraca (+ estável).
Obrigado!
Ravencliff- Iniciante
- Mensagens : 26
Data de inscrição : 28/04/2016
Localização : RJ
 Re: Conceitos de acidez de compostos orgânicos
Re: Conceitos de acidez de compostos orgânicos
Ravencliff,Ravencliff escreveu:Deparei-me com uma tabela que informa que, em termos de força do ácido (acidez), consta:
ácido sulfônico > ácido carboxílico > fenol > água > álcool
Uma das explicações é que a estrutura de ressonância entre oxigênios dá estabilidade à molécula, o que torna a base conjugada estável e fraca, logo o ácido é forte (+ acidez)
Entretanto, queria saber se essa outra justificativa é viável e se está conceitualmente correta:
A estrutura de ressonância favorece o espalhamento de elétrons, o que diminui a densidade eletrônica e, como consequência, diminui a basicidade. Assim, a base conjugada tem menor força e, portanto, é + estável.
Assim, o ácido é + forte (+acidez) porque a base conjugada é estável, portanto fraca (+ estável).
Obrigado!
Eu vou tentar explicar de duas formas, o acido forte sofre ionização com facilidade portanto tem pouca estabilidade, desta forma sua base conjugada tem grande estabilidade portanto é uma base fraca da mesma forma que um acido fraco sofre pouca ionização portanto tem grande estabilidade em contrapartida sua base tem pouca estabilidade por isso trata-se de uma base forte.
Em relacao ao efeito da ressonância no TEXTO abaixo há um comparativo entre um acido acético e o etanol, veja que o acido acético tem menor pKa (maior Ka) que o etanol por isso ioniza com maior facilidade (acido mais forte) em relação ao álcool, ou seja, tem menor estabilidade. (Em tese a base conjugada do etanol é mais forte que a base conjugada do acido acético tendo em vista que possui maior estabilidade).
Agora repare que a base conjugada do etanol nao sofre o efeito da ressonância, algo que acontece com a base do acido acético isso pode ser uma das explicações do motivo da base do etanol ser mais forte do que a do acido acético.
3.4.2. Resonance Effect
The resonance effect accounts for the acidity difference between ethanol and acetic acid. For both ethanol and acetic acid, the hydrogen is bonded with the oxygen atom, so there is no element effect that matters. However, the pK[size=13]a values (and the acidity) of ethanol and acetic acid are very different. What makes a carboxylic acid so much more acidic than an alcohol? As stated before, we begin by considering the stability of the conjugate bases, remembering that a more stable (weaker) conjugate base corresponds to a stronger acid.
[/size]
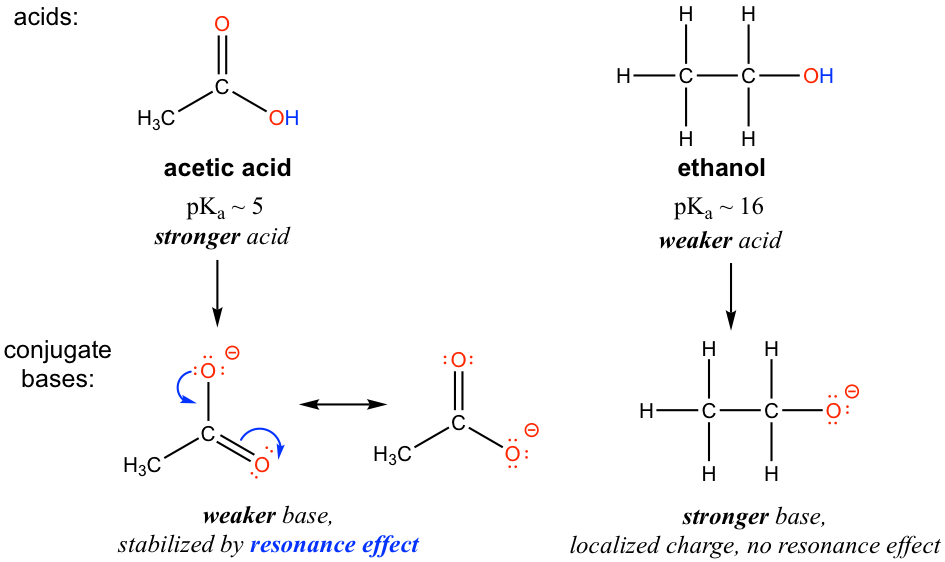
For acetate, the conjugate base of acetic acid, two resonance contributors can be drawn and therefore the negative charge can be delocalized (shared) over two oxygen atoms. However, no other resonance contributor is available in the ethoxide ion, the conjugate base of ethanol, so the negative charge is localized on the oxygen atom. As we have learned in section 1.3, the species that has more resonance contributors gains stability, therefore acetate is more stable than ethoxide, and is weaker as the base, so acetic acid is a stronger acid than ethanol.
The charge delocalization by resonance has a very powerful effect on the reactivity of organic molecules, enough to account for the big difference of over 10 pKaunits between ethanol and acetic acid. Because pKa = –log Ka, that means that there is a factor of about 1010 between the Ka values for the two molecules!
Examples
The pKa of the OH group in alcohol is about 15, however OH in phenol (OH group connected on a benzene ring) has a pKa of about 10, which is much stronger in acidity than other alcohols. Explain the difference.

Solution:
The difference can be explained by the resonance effect. There is no resonance effect on the conjugate base of ethanol, as mentioned before. However, the conjugate base of phenol is stabilized by the resonance effect with four more resonance contributors, and the negative is delocalized on the benzene ring, so the conjugate base of phenol is much more stable and is a weaker base. Therefore phenol is much more acidic than other alcohols.
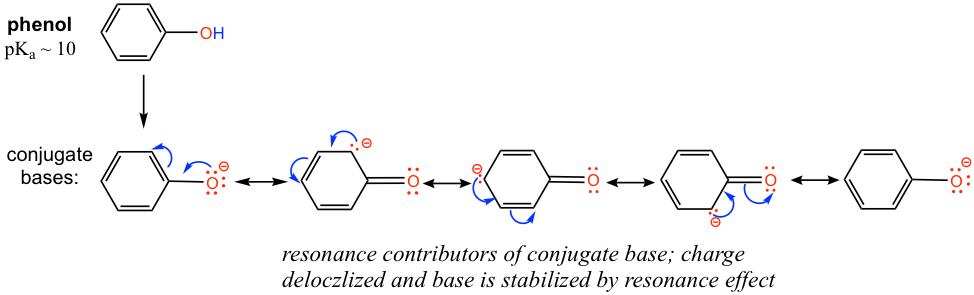
Exercises 3.2
- Practice drawing the resonance structures of the conjugate base of phenol by yourself!
- It is because of the special acidity of phenol (and other aromatic alcohols), that NaOH can be used to deprotonate phenol effectively, but not to normal alcohols, like ethanol. Show the reaction equations of these reactions and explain the difference by applying the pKa values.
Answers to Practice Questions Chapter 3
3.4.3 Inductive Effect
Let’s compare the pK[size=13]a values of acetic acid and its mono-, di-, and tri-chlorinated derivatives:
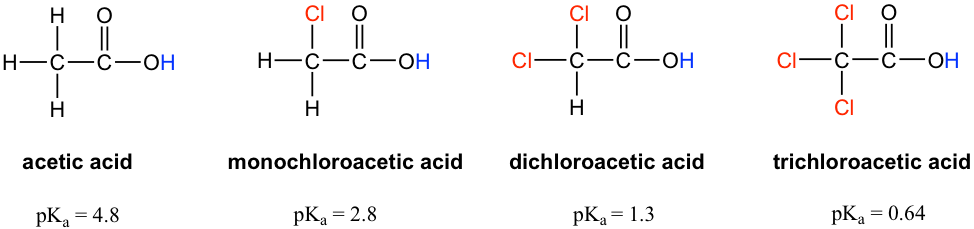 Figure 3.4b Acetic acid and its mono-, di-, and tri-chlorinated derivatives
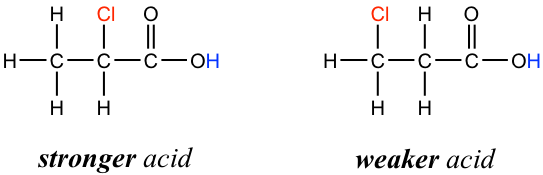
Figure 3.4b Acetic acid and its mono-, di-, and tri-chlorinated derivativesThe presence of the chlorine atoms clearly increases the acidity of the carboxylic acid group, and the argument here apparently does not have to do with the element effect. The resonance effect does not have to do with it either, because no additional resonance contributors can be drawn for the chlorinated molecules. Rather, the explanation for this phenomenon involves something called the inductive effect. A chlorine atom is more electronegative than hydrogen, and is thus able to ‘induce’, or ‘pull’ electron density towards itself via σ bonds in between, and therefore helps to spread out the electron density of the conjugate base, the carboxylate, and stabilize it. The chlorine substituent can be referred to as an electron-withdrawing group because of the inductive effect.
The inductive effect is the charge dispersal effect of electronegative atoms through σ bonds. The inductive effect is addictive; more chlorine atoms have an overall stronger effect, which explains the increasing acidity from mono, to di-, to tri-chlorinated acetic acid. The following diagram shows the inductive effect of trichloro acetate as an example.
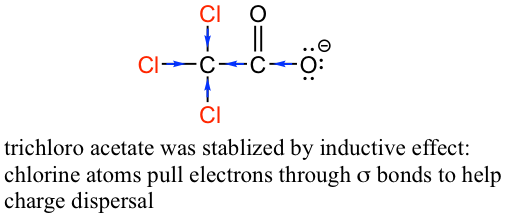 Figure 3.4c Trichloro acetate was stabilized by inductive effect
Figure 3.4c Trichloro acetate was stabilized by inductive effectBecause the inductive effect depends on electronegativity, fluorine substituents have a stronger inductive effect than chlorine substituents, making trifluoroacetic acid (TFA) a very strong organic acid.
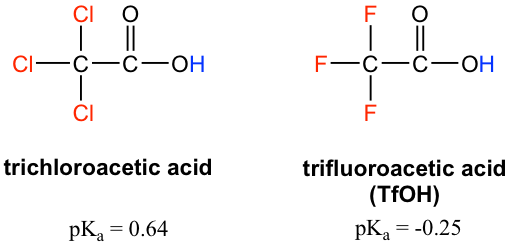 Figure 3.4d trichloroacetic acid (pKa = 0.64) and trifluoroacetic acid (TfOH) (pKa = -0.25)
Figure 3.4d trichloroacetic acid (pKa = 0.64) and trifluoroacetic acid (TfOH) (pKa = -0.25)In addition, because the inductive effect takes place through covalent bonds, its influence decreases significantly with distance — thus a chlorine that is two carbons away from a carboxylic acid group has a weaker effect compared to a chlorine just one carbon away.
[/size]
https://chem.libretexts.org/Bookshelves/Organic_Chemistry/Organic_Chemistry_I_(Liu)/03%3A_Acids_and_Bases-_Organic_Reaction_Mechanism_Introduction/3.04%3A_Structural_Effects_on_Acidity_and_Basicity

Jigsaw- Monitor

- Mensagens : 772
Data de inscrição : 26/12/2020
Localização : São Paulo/SP
Ravencliff gosta desta mensagem
 Re: Conceitos de acidez de compostos orgânicos
Re: Conceitos de acidez de compostos orgânicos
Obrigado pela resposta detalhada e esclarecedora!
Ravencliff- Iniciante
- Mensagens : 26
Data de inscrição : 28/04/2016
Localização : RJ
 Tópicos semelhantes
Tópicos semelhantes» Acidez de Compostos Orgânicos I
» Basicidade e Acidez de Compostos Orgânicos
» FGV-SP Compostos orgânicos
» Basicidade e Acidez em Compostos Orgânicos
» Acidez e Basicidade em Orgânicos
» Basicidade e Acidez de Compostos Orgânicos
» FGV-SP Compostos orgânicos
» Basicidade e Acidez em Compostos Orgânicos
» Acidez e Basicidade em Orgânicos
PiR2 :: Química :: Química Orgânica
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












