Modelo atômico de Bohr vs equação de De Broglie
2 participantes
Página 1 de 1
 Modelo atômico de Bohr vs equação de De Broglie
Modelo atômico de Bohr vs equação de De Broglie
Pessoal, dando uma revisada em atomística eu reencontrei uma fórmula curiosa e ainda não consegui encontrar a demonstração para a mesma, que é 2πr = nλ. As imagens a seguir são a respeito dessa fórmula:
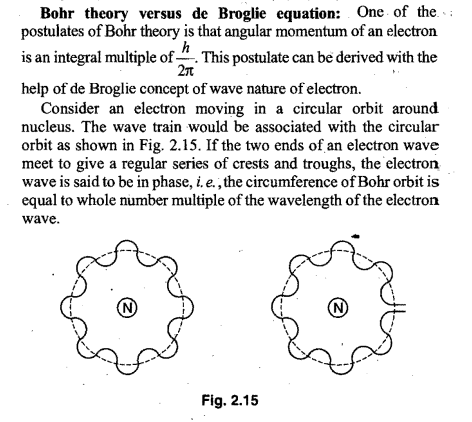

Ainda que possa talvez envolver ensino superior eu gostaria de conhecer a origem da fórmula, por favor. Obrigado!


Ainda que possa talvez envolver ensino superior eu gostaria de conhecer a origem da fórmula, por favor. Obrigado!
Última edição por Rubro em Sex 21 Set 2018, 17:38, editado 1 vez(es)
Rubro- Iniciante
- Mensagens : 31
Data de inscrição : 10/12/2017
 Re: Modelo atômico de Bohr vs equação de De Broglie
Re: Modelo atômico de Bohr vs equação de De Broglie
eae , quanto tempo...
meu cel foi roubado por isso não escrevi mais nada , não sabia por onde te avisar e tal...
como vão as coisas ??
então cara, 2.(pi).r=C (comprimento da circunferência)
essa circunferência é divida em 'n' comprimentos de onda, como mostrado na figura, logo podemos igualar:
2.(pi).r=n.(lambda)
mas da equação de De Broglie , sabemos que partículas se comportam como ondas , tendo o seu comprimento de onda dado por:
(lambda)=h/mv
em que 'h'--->constante de planck
substituindo na igualdade do comprimento da circunferência com n.(lambda) , temos:
2.(pi).r=n.h/m.v
passando o 'm.v' para cima e o '2.(pi)' para baixo , teremos:
m.v.r=n.h/2.(pi)
'm.v.r'= momento angular.
vem daí a igualdade.
meu cel foi roubado por isso não escrevi mais nada , não sabia por onde te avisar e tal...
como vão as coisas ??
então cara, 2.(pi).r=C (comprimento da circunferência)
essa circunferência é divida em 'n' comprimentos de onda, como mostrado na figura, logo podemos igualar:
2.(pi).r=n.(lambda)
mas da equação de De Broglie , sabemos que partículas se comportam como ondas , tendo o seu comprimento de onda dado por:
(lambda)=h/mv
em que 'h'--->constante de planck
substituindo na igualdade do comprimento da circunferência com n.(lambda) , temos:
2.(pi).r=n.h/m.v
passando o 'm.v' para cima e o '2.(pi)' para baixo , teremos:
m.v.r=n.h/2.(pi)
'm.v.r'= momento angular.
vem daí a igualdade.

Matheus Tsilva- Fera

- Mensagens : 1240
Data de inscrição : 16/07/2015
Idade : 26
Localização : Uberaba, MG
 Re: Modelo atômico de Bohr vs equação de De Broglie
Re: Modelo atômico de Bohr vs equação de De Broglie
Tempo mesmo, em? Dei uma sumida do fórum porque fui fazer cursinho presencial, mas me arrependi. Valeu demais pela ajuda, irmão, agora estou de volta à ativaMatheus Tsilva escreveu:eae , quanto tempo...
meu cel foi roubado por isso não escrevi mais nada , não sabia por onde te avisar e tal...
como vão as coisas ??
então cara, 2.(pi).r=C (comprimento da circunferência)
essa circunferência é divida em 'n' comprimentos de onda, como mostrado na figura, logo podemos igualar:
2.(pi).r=n.(lambda)
mas da equação de De Broglie , sabemos que partículas se comportam como ondas , tendo o seu comprimento de onda dado por:
(lambda)=h/mv
em que 'h'--->constante de planck
substituindo na igualdade do comprimento da circunferência com n.(lambda) , temos:
2.(pi).r=n.h/m.v
passando o 'm.v' para cima e o '2.(pi)' para baixo , teremos:
m.v.r=n.h/2.(pi)
'm.v.r'= momento angular.
vem daí a igualdade.

Rubro- Iniciante
- Mensagens : 31
Data de inscrição : 10/12/2017
 Re: Modelo atômico de Bohr vs equação de De Broglie
Re: Modelo atômico de Bohr vs equação de De Broglie
Sim , claro...
Tmj
Tmj

Matheus Tsilva- Fera

- Mensagens : 1240
Data de inscrição : 16/07/2015
Idade : 26
Localização : Uberaba, MG
 Re: Modelo atômico de Bohr vs equação de De Broglie
Re: Modelo atômico de Bohr vs equação de De Broglie
Rubro escreveu:Pessoal, dando uma revisada em atomística eu reencontrei uma fórmula curiosa e ainda não consegui encontrar a demonstração para a mesma, que é 2πr = nλ. As imagens a seguir são a respeito dessa fórmula:
Ainda que possa talvez envolver ensino superior eu gostaria de conhecer a origem da fórmula, por favor. Obrigado!
É livro de qual editora? Autor? O título da capa?
Convidado- Convidado
 Tópicos semelhantes
Tópicos semelhantes» Modelo Atômico de Bohr
» Espectro descontínuo (Modelo atômico de Bohr)
» Modelo atômico de Bohr.
» Modelo atômico de Niels Bohr - dúvida teórica
» Modelo atômico de Niels Bohr
» Espectro descontínuo (Modelo atômico de Bohr)
» Modelo atômico de Bohr.
» Modelo atômico de Niels Bohr - dúvida teórica
» Modelo atômico de Niels Bohr
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












