Esse composto orgânico poderá ser?
3 participantes
Página 1 de 1
 Esse composto orgânico poderá ser?
Esse composto orgânico poderá ser?
UEL
A combustão completa de 0,10 mol de um composto orgânico constituído de carbono, hidrogênio e oxigênio gastou 0,30 mol de O2 e produziu 8,8g de dióxido de carbono e 5,4g de água. Esse composto orgânico poderá ser?
Gabarito:
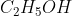
A combustão completa de 0,10 mol de um composto orgânico constituído de carbono, hidrogênio e oxigênio gastou 0,30 mol de O2 e produziu 8,8g de dióxido de carbono e 5,4g de água. Esse composto orgânico poderá ser?
Gabarito:

Adam Zunoeta- Monitor

- Mensagens : 4223
Data de inscrição : 25/08/2010
Idade : 35
Localização : Cuiabá
 Re: Esse composto orgânico poderá ser?
Re: Esse composto orgânico poderá ser?
Oi Balanar,
pra fazer esse exercício de análise de combustão você precisa saber que o hidrogênio do composto converte-se em H2O e o carbono converte-se em CO2.
O oxigênio sempre vai estar em excesso. Isso faz com que a amostra analisada seja o reagente limitante.
Convertendo em número de mol as massas de CO2 e H2O e depois achando os números de mol de C e H e suas respectivas massas:
n = 8,8 / 44 = 0,2 mol de CO2
n = 5,4 / 18 = 0,3 mol de H2O
1 mol de CO2 ------ 1 mol de C
0,2 mol de CO2 ---- X
X = 0,2 mol de C
1 mol de C ----- 12 g
0,2 mol de C --- X
X = 2,4 g de C
1 mol de H2O ------ 2 mols de H
0,3 mol de H2O ---- Y
Y = 0,6 mol de H
1 mol de H ----- 1 g
0,6 mol de H --- Y
Y = 0,6 g de H
Encontrando a massa de O2 que foi posta para reagir:
0,3 = m / 32
m = 9,6 g de O2
Montando a equação e aplicando a Lei da Conservação da Massa:
CxHyOz + O2 ===> CO2 + H2O
X g de CxHyOz + 9,6 g de O2 = 8,8 g de CO2 + 5,4 g de H2O
X = 4,6 g de CxHyOz
A quantidade de oxigênio é encontrada pela diferença da massa do composto e da massa de C e H:
m de O = 4,6 g - 2,4 g - 0,6 g = 1,6 g de O
Encontrando o número de mol de O:
n = 1,6 / 16 = 0,1 mol de O
Finalmente, nós achamos os seguintes resultados:
0,2 mol de C
0,6 mol de H
0,1 mol de O
Dividindo todos pelo menor:
0,2 / 0,1 = 2 mol de C
0,6 / 0,1 = 6 mol de H
0,1 / 0,1 = 1 mol de O
Fórmula molecular: C2H6O
No gabarito eles puseram o etanol que é o composto orgânico oxigenado mais provável de ser com apenas 2 mols de átomos de carbono. Não poderia ser o etanal (aldeído) pois tem fórmula molecular C2H4O, nem o ácido etanóico (C2H4O2 - ácido carboxílico), nem uma cetona pois não existe "etanona". A cetona mais simples é a propanona.
Pergunte se não entendeu alguma coisa. Se tu quiser eu mando um exemplo do livro do Atkins que me ajudou a resolver esse exercício.
Hasta la vista!
pra fazer esse exercício de análise de combustão você precisa saber que o hidrogênio do composto converte-se em H2O e o carbono converte-se em CO2.
O oxigênio sempre vai estar em excesso. Isso faz com que a amostra analisada seja o reagente limitante.
Convertendo em número de mol as massas de CO2 e H2O e depois achando os números de mol de C e H e suas respectivas massas:
n = 8,8 / 44 = 0,2 mol de CO2
n = 5,4 / 18 = 0,3 mol de H2O
1 mol de CO2 ------ 1 mol de C
0,2 mol de CO2 ---- X
X = 0,2 mol de C
1 mol de C ----- 12 g
0,2 mol de C --- X
X = 2,4 g de C
1 mol de H2O ------ 2 mols de H
0,3 mol de H2O ---- Y
Y = 0,6 mol de H
1 mol de H ----- 1 g
0,6 mol de H --- Y
Y = 0,6 g de H
Encontrando a massa de O2 que foi posta para reagir:
0,3 = m / 32
m = 9,6 g de O2
Montando a equação e aplicando a Lei da Conservação da Massa:
CxHyOz + O2 ===> CO2 + H2O
X g de CxHyOz + 9,6 g de O2 = 8,8 g de CO2 + 5,4 g de H2O
X = 4,6 g de CxHyOz
A quantidade de oxigênio é encontrada pela diferença da massa do composto e da massa de C e H:
m de O = 4,6 g - 2,4 g - 0,6 g = 1,6 g de O
Encontrando o número de mol de O:
n = 1,6 / 16 = 0,1 mol de O
Finalmente, nós achamos os seguintes resultados:
0,2 mol de C
0,6 mol de H
0,1 mol de O
Dividindo todos pelo menor:
0,2 / 0,1 = 2 mol de C
0,6 / 0,1 = 6 mol de H
0,1 / 0,1 = 1 mol de O
Fórmula molecular: C2H6O
No gabarito eles puseram o etanol que é o composto orgânico oxigenado mais provável de ser com apenas 2 mols de átomos de carbono. Não poderia ser o etanal (aldeído) pois tem fórmula molecular C2H4O, nem o ácido etanóico (C2H4O2 - ácido carboxílico), nem uma cetona pois não existe "etanona". A cetona mais simples é a propanona.
Pergunte se não entendeu alguma coisa. Se tu quiser eu mando um exemplo do livro do Atkins que me ajudou a resolver esse exercício.
Hasta la vista!
Luís- Estrela Dourada

- Mensagens : 1177
Data de inscrição : 09/02/2011
 Re: Esse composto orgânico poderá ser?
Re: Esse composto orgânico poderá ser?
Eu fiz assim:
CxHyOz - O2 -> CO2 + H2O
CxHyOz => 0,1MOL
O2 => 0,3MOL
CO2 => 8,8g
H2O => 5,4g
Achando nº de mol do CO2:
44,0g --- 1mol
8,80g --- a
a = 0,2mol
Nº de mol de H2O:
18,0g --- 1mol
5,40g --- b
b = 0,3mol
Então a equação é:
[0,1]CxHyOz - [0,3]O2 -> [0,2]CO2 + [0,3]H2O
Multiplicando tudo por 10 afim de que os coeficientes e tornem interios temos:
1CxHyOz - 3O2 -> 2CO2 + 3H2O
Logo:
x = 2
y = 6
O = 1
Então o composto pedido apresenta a seguinte formula molecular: C2H5OH
CxHyOz - O2 -> CO2 + H2O
CxHyOz => 0,1MOL
O2 => 0,3MOL
CO2 => 8,8g
H2O => 5,4g
Achando nº de mol do CO2:
44,0g --- 1mol
8,80g --- a
a = 0,2mol
Nº de mol de H2O:
18,0g --- 1mol
5,40g --- b
b = 0,3mol
Então a equação é:
[0,1]CxHyOz - [0,3]O2 -> [0,2]CO2 + [0,3]H2O
Multiplicando tudo por 10 afim de que os coeficientes e tornem interios temos:
1CxHyOz - 3O2 -> 2CO2 + 3H2O
Logo:
x = 2
y = 6
O = 1
Então o composto pedido apresenta a seguinte formula molecular: C2H5OH
____________________________________________
"Quando recebemos um ensinamento devemos receber como um valioso presente e não como uma dura tarefa. Eis aqui a diferença que transcende."
Albert Einstein

arimateiab- Elite Jedi

- Mensagens : 776
Data de inscrição : 01/07/2010
Idade : 31
Localização : Estudante de Engenharia de Produção na UFPE.
Fibonacci13 gosta desta mensagem
 Re: Esse composto orgânico poderá ser?
Re: Esse composto orgânico poderá ser?
Show de bola galera
Vlw Luís e arimateiab

Vlw Luís e arimateiab

Adam Zunoeta- Monitor

- Mensagens : 4223
Data de inscrição : 25/08/2010
Idade : 35
Localização : Cuiabá
 Tópicos semelhantes
Tópicos semelhantes» Composto orgânico
» Composto organico
» Composto orgânico
» Composto orgânico - Unicamp
» Acidez composto orgânico
» Composto organico
» Composto orgânico
» Composto orgânico - Unicamp
» Acidez composto orgânico
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












