Velocidade da reação
2 participantes
Página 1 de 1
 Velocidade da reação
Velocidade da reação
(UFRJ) O monóxido de carbono e o dióxido de carbono coexistem em equilíbrio quando são colocados em um recipiente fechado, a temperatura constante. O gráfico a seguir representa a variação do número de mols com o tempo quando a reação apresentada é realizada em um recipiente de 1 litro.
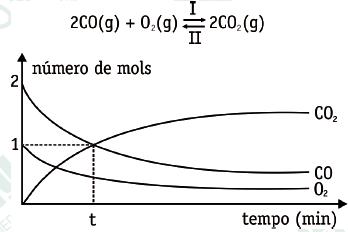
Sabendo-se que, até atingir o equilíbrio, 1,5 mols de monóxido de carbono foram consumidos, calcule a razão entre as velocidades das reações I e II (v1/v2) no instante t indicado no gráfico.

Sabendo-se que, até atingir o equilíbrio, 1,5 mols de monóxido de carbono foram consumidos, calcule a razão entre as velocidades das reações I e II (v1/v2) no instante t indicado no gráfico.
- Spoiler:
- v1/v2=18
Liliana Rodrigues- Estrela Dourada

- Mensagens : 2082
Data de inscrição : 16/03/2016
Idade : 27
Localização : Ribeirão Preto - SP
 Re: Velocidade da reação
Re: Velocidade da reação
Olá Liliana,
Sabendo que o volume é de 1L.
Pelo gráfico, conseguimos o número de mols antes da reação ocorrer.
Também sabemos que até a reação atingir o equilíbrio foram consumidos 1,5 mol de CO, o que nos permite montar a seguinte tabela:
2CO(g) + O2(g) <-----> 2CO2(g)
Início: 2mols 1mol Zero
Reagem: -1,5mol -0,75mol +1,5mol
Equilíbrio: 0,5 mol 0,25 mol 1,5mol
Montando as duas leis da velocidade para a reação em equilíbrio:
v1= k1.[CO]²[O2] ; v2= k2.[CO2]²
Ainda sabemos que no equilíbrio a velocidade da reação direta (v1) deve ser igual a velocidade da reação inversa (v2), portanto:
v1 = v2 → k1[CO]²[O2] = k2[CO2]² → k1/k2 = [CO2]² / [CO]²[O2] →
→ k1/k2 = (1,5)² / (0,5)².(0,25) → k1/k2 = 36
Sabemos que no instante ''t'', o número de mols de CO2 e CO são iguais e isso só irá ocorrer quando o número de mols de CO2 e CO forem iguais a 1, assim temos as seguintes concentrações nesse instante:
[CO2] = 1mol/L
[CO] = 1mol/L
[O2] = 0,5 mol/L (pela reação e coeficientes estequiométricos, sabemos que quando 1mol de CO2 é consumido, metade de O2 deve ser consumido)
Agora montando as leis para o instante ''t'':
v1= k1.[CO]²[O2] ; v2= k2.[CO2]²
v1 = k1.(1²).(0,5) ; v2 = k2.(1²)
Dividindo v1 e v2:
v1/v2 = (k1/k2).0,5 mas calculamos k1/k2 = 36, portanto:
v1/v2 = 18
Sabendo que o volume é de 1L.
Pelo gráfico, conseguimos o número de mols antes da reação ocorrer.
Também sabemos que até a reação atingir o equilíbrio foram consumidos 1,5 mol de CO, o que nos permite montar a seguinte tabela:
2CO(g) + O2(g) <-----> 2CO2(g)
Início: 2mols 1mol Zero
Reagem: -1,5mol -0,75mol +1,5mol
Equilíbrio: 0,5 mol 0,25 mol 1,5mol
Montando as duas leis da velocidade para a reação em equilíbrio:
v1= k1.[CO]²[O2] ; v2= k2.[CO2]²
Ainda sabemos que no equilíbrio a velocidade da reação direta (v1) deve ser igual a velocidade da reação inversa (v2), portanto:
v1 = v2 → k1[CO]²[O2] = k2[CO2]² → k1/k2 = [CO2]² / [CO]²[O2] →
→ k1/k2 = (1,5)² / (0,5)².(0,25) → k1/k2 = 36
Sabemos que no instante ''t'', o número de mols de CO2 e CO são iguais e isso só irá ocorrer quando o número de mols de CO2 e CO forem iguais a 1, assim temos as seguintes concentrações nesse instante:
[CO2] = 1mol/L
[CO] = 1mol/L
[O2] = 0,5 mol/L (pela reação e coeficientes estequiométricos, sabemos que quando 1mol de CO2 é consumido, metade de O2 deve ser consumido)
Agora montando as leis para o instante ''t'':
v1= k1.[CO]²[O2] ; v2= k2.[CO2]²
v1 = k1.(1²).(0,5) ; v2 = k2.(1²)
Dividindo v1 e v2:
v1/v2 = (k1/k2).0,5 mas calculamos k1/k2 = 36, portanto:
v1/v2 = 18
igorrudolf- Jedi

- Mensagens : 434
Data de inscrição : 10/09/2014
Idade : 28
Localização : São Paulo - São Paulo
Ian Fáuzi gosta desta mensagem
 Re: Velocidade da reação
Re: Velocidade da reação
Muito obrigada!!! 
Liliana Rodrigues- Estrela Dourada

- Mensagens : 2082
Data de inscrição : 16/03/2016
Idade : 27
Localização : Ribeirão Preto - SP
 Tópicos semelhantes
Tópicos semelhantes» Lei da Velocidade, Velocidade da reação e Expressão da Constante
» Velocidade da reação
» Velocidade da reação
» A velocidade de reação
» Velocidade da reacao
» Velocidade da reação
» Velocidade da reação
» A velocidade de reação
» Velocidade da reacao
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|













