Eletrolise
3 participantes
PiR2 :: Química :: Físico-Química
Página 1 de 2
Página 1 de 2 • 1, 2 
 Eletrolise
Eletrolise
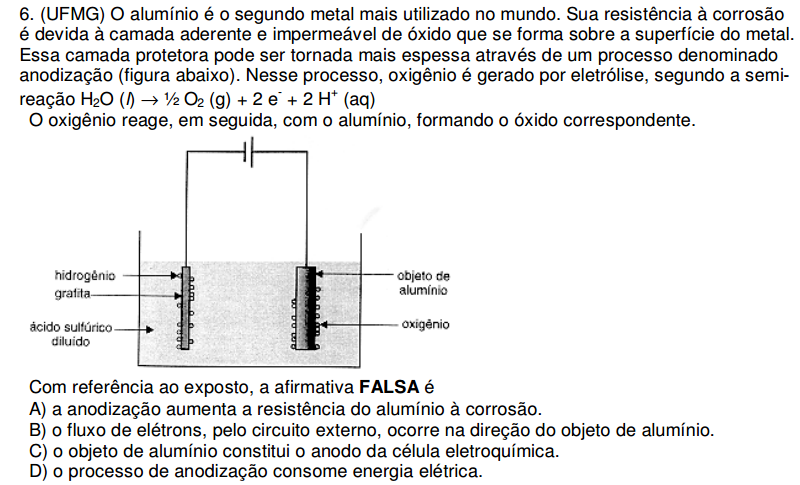
O alumínio é o segundo metal mais utilizado no mundo. Sua resistência à corrosão é devida à camada aderente e impermeável de óxido que se forma sobre a superfície do metal. Essa camada protetora pode ser tornada mais espessa através de um processo denominado anodização (figura abaixo). Nesse processo, oxigênio é gerado por eletrólise, segundo a semireação
H2O (l) → ½ O2 (g) + 2e- + 2H+ (aq)
O oxigênio reage, em seguida, com o alumínio, formando o óxido correspondente.
Com referência ao exposto, a afirmativa FALSA é
A) a anodização aumenta a resistência do alumínio à corrosão.
B) o fluxo de elétrons, pelo circuito externo, ocorre na direção do objeto de alumínio.
C) o objeto de alumínio constitui o anodo da célula eletroquímica.
D) o processo de anodização consome energia elétrica.
H2O (l) → ½ O2 (g) + 2e- + 2H+ (aq)
O oxigênio reage, em seguida, com o alumínio, formando o óxido correspondente.
Com referência ao exposto, a afirmativa FALSA é
A) a anodização aumenta a resistência do alumínio à corrosão.
B) o fluxo de elétrons, pelo circuito externo, ocorre na direção do objeto de alumínio.
C) o objeto de alumínio constitui o anodo da célula eletroquímica.
D) o processo de anodização consome energia elétrica.


EstudanteCiencias- Jedi

- Mensagens : 358
Data de inscrição : 17/07/2016
Idade : 25
Localização : Salvador - Bahia
 Re: Eletrolise
Re: Eletrolise
É uma eletrólise...
Basta ver a polaridade da bateria: a corrente vai para a direita ---> os elétrons vão para a esquerda (contrários alumínio).
Basta ver a polaridade da bateria: a corrente vai para a direita ---> os elétrons vão para a esquerda (contrários alumínio).
____________________________________________
"Death is so terribly final, while life is full of possibilities." - Tyrion Lannister
 Re: Eletrolise
Re: Eletrolise
O anodo não é de onde os eletrons saem? O aluminio neste caso nao seria o anodo? A menos que eu tenha interpretado errado, no lado direito ocorre a reação Al(s) → Al³+ + 3e- que posteriormente reagiria com o O2 produzindo Al2O3. Por sinal, qual a semi reações que ocorre no lado esquerdo?

EstudanteCiencias- Jedi

- Mensagens : 358
Data de inscrição : 17/07/2016
Idade : 25
Localização : Salvador - Bahia
 Re: Eletrolise
Re: Eletrolise
____________________________________________
"Death is so terribly final, while life is full of possibilities." - Tyrion Lannister
 Re: Eletrolise
Re: Eletrolise
Na solução não existem elétrons nadando !!!
A corrente elétrica na solução existe pelo fluxo de íons:
Ânions (-) indo para o polo positivo, anodo de alumínio
Cátions (+) para o polo negativo, cátodo de grafite.
No circuito externo, a convenção é a da Eletricidade, que, por motivos históricos, é como se fosse o sentido cargas positivas fluindo de um potencial maior — a maior barra da fonte elétrica (bateria) — para um potencial menor, a menor barra da fonte.
Logo, na realidade, os elétrons fluem no sentido oposto ao sentido convencional.
Definições:
Anodo: elétrodo positivo que recebe ânions, "caminho dos ânions".
Cátodo: elétrodo negativo que recebe cátions, "caminho dos cátions".
A corrente elétrica na solução existe pelo fluxo de íons:
Ânions (-) indo para o polo positivo, anodo de alumínio
Cátions (+) para o polo negativo, cátodo de grafite.
No circuito externo, a convenção é a da Eletricidade, que, por motivos históricos, é como se fosse o sentido cargas positivas fluindo de um potencial maior — a maior barra da fonte elétrica (bateria) — para um potencial menor, a menor barra da fonte.
Logo, na realidade, os elétrons fluem no sentido oposto ao sentido convencional.
Definições:
Anodo: elétrodo positivo que recebe ânions, "caminho dos ânions".
Cátodo: elétrodo negativo que recebe cátions, "caminho dos cátions".
rihan- Estrela Dourada

- Mensagens : 5049
Data de inscrição : 22/08/2011
Idade : 69
Localização : Rio de Janeiro, RJ, Itabuna-Ilhéus, BA, Brasil
 Re: Eletrolise
Re: Eletrolise
Galera, a semi reação de oxidação no anodo nao deveria ser 2OH- → H2O + 1/2 O2 + 2e- ?

EstudanteCiencias- Jedi

- Mensagens : 358
Data de inscrição : 17/07/2016
Idade : 25
Localização : Salvador - Bahia
 Re: Eletrolise
Re: Eletrolise
Por que?EstudanteCiencias escreveu:Galera, a semi reação de oxidação no anodo nao deveria ser 2OH- → H2O + 1/2 O2 + 2e- ?
____________________________________________
"Death is so terribly final, while life is full of possibilities." - Tyrion Lannister
 Re: Eletrolise
Re: Eletrolise
Cátodo: 2 H2O + 2e− → H2 + 2 OH− Eo
red = 0.00 V (Padrão de Referência)
Ânodo: 4 OH− → O2 + 2 H2O + 4 e− Eo
ox = -1.23 V (Eo
red = 1.23 )
====================================
Total: 2 H2O → 2 H2 + O2
OU:
Cátodo: 4 H+ + 4e− → 2 H2
Ânodo: 2 H2O → O2 + 4 H+ + 4e−
====================================
Total: 2 H2O → 2 H2 + O2
OU:
Cátodo: 4 H3O+ + 4e− → 2 H2 + 4 H2O
Ânodo: 6 H2O → O2 + 4 H3O+ + 4e−
====================================
Total: 2 H2O → 2 H2 + O2
Dá no mesmo...
:face:Pra que simplificar se nóis pudemu cumpricar ! :face:
red = 0.00 V (Padrão de Referência)
Ânodo: 4 OH− → O2 + 2 H2O + 4 e− Eo
ox = -1.23 V (Eo
red = 1.23 )
====================================
Total: 2 H2O → 2 H2 + O2
OU:
Cátodo: 4 H+ + 4e− → 2 H2
Ânodo: 2 H2O → O2 + 4 H+ + 4e−
====================================
Total: 2 H2O → 2 H2 + O2
OU:
Cátodo: 4 H3O+ + 4e− → 2 H2 + 4 H2O
Ânodo: 6 H2O → O2 + 4 H3O+ + 4e−
====================================
Total: 2 H2O → 2 H2 + O2
Dá no mesmo...
:face:Pra que simplificar se nóis pudemu cumpricar ! :face:
rihan- Estrela Dourada

- Mensagens : 5049
Data de inscrição : 22/08/2011
Idade : 69
Localização : Rio de Janeiro, RJ, Itabuna-Ilhéus, BA, Brasil
 Re: Eletrolise
Re: Eletrolise
Pre-Iteano, eu pensei que ocorreria a eletrolise da agua, onde:
Reação catodica:
2H3O+ + 2e- → H2 + 2H2O
Reação anodica:
2OH- → H2O + 1/2 O2 + 2e-
Reação global:
2H3O + 2OH- → H2 + 3H2O + 1/2 O2
Reação catodica:
2H3O+ + 2e- → H2 + 2H2O
Reação anodica:
2OH- → H2O + 1/2 O2 + 2e-
Reação global:
2H3O + 2OH- → H2 + 3H2O + 1/2 O2

EstudanteCiencias- Jedi

- Mensagens : 358
Data de inscrição : 17/07/2016
Idade : 25
Localização : Salvador - Bahia
 Re: Eletrolise
Re: Eletrolise
Beleza, muito obrigado pre-iteano e rihan. Esclareceu tudo!

EstudanteCiencias- Jedi

- Mensagens : 358
Data de inscrição : 17/07/2016
Idade : 25
Localização : Salvador - Bahia
Página 1 de 2 • 1, 2 
PiR2 :: Química :: Físico-Química
Página 1 de 2
Permissões neste sub-fórum
Não podes responder a tópicos













