Ligações químicas
2 participantes
Página 1 de 1
 Ligações químicas
Ligações químicas
a) Admitindo-se que, na formação da molécula de H2O, sejam usados, para as ligações, os orbitais atômicos do oxigênio no estado fundamental, prediga, justificando, que ângulo seria formado entre as ligações nessa molécula.
b) Na realidade, o ângulo observado entre as ligações na molécula de H2O é de aproximadamente 105º. Que modelo foi adotado para explicar esse fato? Justifique sucintamente sua resposta.
b) Na realidade, o ângulo observado entre as ligações na molécula de H2O é de aproximadamente 105º. Que modelo foi adotado para explicar esse fato? Justifique sucintamente sua resposta.

Pedro Prado- Mestre Jedi

- Mensagens : 553
Data de inscrição : 05/06/2015
Idade : 23
Localização : Rio de Janeiro - RJ - Brasil
rihan- Estrela Dourada

- Mensagens : 5049
Data de inscrição : 22/08/2011
Idade : 69
Localização : Rio de Janeiro, RJ, Itabuna-Ilhéus, BA, Brasil
 Re: Ligações químicas
Re: Ligações químicas
Já tenho esse conhecimento, no entanto os problemas foram:
a) prediga, justificando, que ângulo seria formado entre as ligações nessa molécula.
Pensei ser 120º pela teoria de repulsão, e devido ao fato da molécula ser angular, mas o gabarito é 90º
b) Foi o TRPEV? Creio que tenha sido algo relacionado a hibridações (esse modelo dos orbitais moleculares está muito desconexo na minha cabeça)
a) prediga, justificando, que ângulo seria formado entre as ligações nessa molécula.
Pensei ser 120º pela teoria de repulsão, e devido ao fato da molécula ser angular, mas o gabarito é 90º
b) Foi o TRPEV? Creio que tenha sido algo relacionado a hibridações (esse modelo dos orbitais moleculares está muito desconexo na minha cabeça)

Pedro Prado- Mestre Jedi

- Mensagens : 553
Data de inscrição : 05/06/2015
Idade : 23
Localização : Rio de Janeiro - RJ - Brasil
 Re: Ligações químicas
Re: Ligações químicas
0) No nível médio temos 4 teorias básicas para as ligações químicas:
a) Teoria do Octeto (TO): Explica a Fórmula Estrutural
b) Teoria da Repulsão dos Pares Eletrônicos de Valência (TRPEV): Explica qualitativamente a geometria molecular
c) Teoria Dos Orbitais Moleculares (TOM) e a Teoria da Ligação de Valência (TLV): Explica as ligações covalentes e as hibridizações.
1) H - O - H
No seu estado fundamental, o Oxigênio (Z= , tem a seguinte configuração eletrônica:
, tem a seguinte configuração eletrônica:
1s2 2s2 p4
Ou seja, pela Regra do Octeto (Lewis), ele precisa de 2 elétrons, que serão compartilhados com os elétrons do Hidrogênio (Z=1):
1s¹
Em um par de pares covalentes, ou seja, duas ligações covalentes.
Espacialmente, pelas diferenças de campos elétricos , não se considerando os 2 elétrons do oxigênio que não participaram da festinha e ficaram solitários, a geometria deveria ter os 2 hidrogênios fazendo um ângulo reto entre si e o oxigênio no vértice desse ângulo.
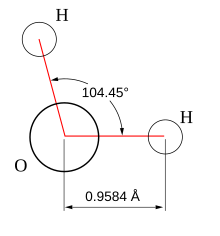
Mas, se pensarmos em repulsões, temos os 2 Hidrogênios se repelindo, abrindo o ângulo reto, mas, esses elétrons de valência das legações de covalentes acabam sendo repelidos pelos 2 elétrons solitários, que não formaram par, fazendo com que esse ângulo estacione em 104,5°.
2) Hibridização (Geração de Híbrido):
O Carbono (Z=6) tem a seguinte configuração eletrônica no seu estado fundamental:
1s2 2s2 2px1 2py1 2pz0
Por algum motivo energético, ao se combinar com o hidrogênio para formar o CH4 (Metano),os elétrons do nível 2 se "misturam", gerando orbitais novos.
Da mesma forma que quando um jumento se "mistura" com égua, gerando um burro, chamado de híbrido, os químicos assim também batizaram esses novos orbitais, e o processo foi chamado, delicadamente, de "hibridização".
Eles ficam assim:
1s2 2s1 2px1 2py1 2pz1
Então, tem-se agora a possibilidade de acontecer 4 ligações covalentes, uma com cada hidrogênio contribuindo com 1 elétron para o preenchimento dos orbitais hibridizados do Carbono, formando-se 4 pares, isto é, 4 ligações covalentes.
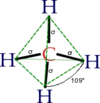
No espaço, a forma mais equilibrada disso acontecer e se manter estável, é o Carbono ocupando o centro de um tetraedro regular, tendo os hidrogênios em seus vértices:
Essas ligações covalentes simples são chamadas de SIGMA (σ, o "s" grego).
No nível médio, você vai ver isso em Química Orgânica.
a) Teoria do Octeto (TO): Explica a Fórmula Estrutural
b) Teoria da Repulsão dos Pares Eletrônicos de Valência (TRPEV): Explica qualitativamente a geometria molecular
c) Teoria Dos Orbitais Moleculares (TOM) e a Teoria da Ligação de Valência (TLV): Explica as ligações covalentes e as hibridizações.
1) H - O - H
No seu estado fundamental, o Oxigênio (Z=
1s2 2s2 p4
Ou seja, pela Regra do Octeto (Lewis), ele precisa de 2 elétrons, que serão compartilhados com os elétrons do Hidrogênio (Z=1):
1s¹
Em um par de pares covalentes, ou seja, duas ligações covalentes.
Espacialmente, pelas diferenças de campos elétricos , não se considerando os 2 elétrons do oxigênio que não participaram da festinha e ficaram solitários, a geometria deveria ter os 2 hidrogênios fazendo um ângulo reto entre si e o oxigênio no vértice desse ângulo.
Mas, se pensarmos em repulsões, temos os 2 Hidrogênios se repelindo, abrindo o ângulo reto, mas, esses elétrons de valência das legações de covalentes acabam sendo repelidos pelos 2 elétrons solitários, que não formaram par, fazendo com que esse ângulo estacione em 104,5°.

2) Hibridização (Geração de Híbrido):
O Carbono (Z=6) tem a seguinte configuração eletrônica no seu estado fundamental:
1s2 2s2 2px1 2py1 2pz0
Por algum motivo energético, ao se combinar com o hidrogênio para formar o CH4 (Metano),os elétrons do nível 2 se "misturam", gerando orbitais novos.
Da mesma forma que quando um jumento se "mistura" com égua, gerando um burro, chamado de híbrido, os químicos assim também batizaram esses novos orbitais, e o processo foi chamado, delicadamente, de "hibridização".
Eles ficam assim:
1s2 2s1 2px1 2py1 2pz1
Então, tem-se agora a possibilidade de acontecer 4 ligações covalentes, uma com cada hidrogênio contribuindo com 1 elétron para o preenchimento dos orbitais hibridizados do Carbono, formando-se 4 pares, isto é, 4 ligações covalentes.
No espaço, a forma mais equilibrada disso acontecer e se manter estável, é o Carbono ocupando o centro de um tetraedro regular, tendo os hidrogênios em seus vértices:

Essas ligações covalentes simples são chamadas de SIGMA (σ, o "s" grego).
No nível médio, você vai ver isso em Química Orgânica.
rihan- Estrela Dourada

- Mensagens : 5049
Data de inscrição : 22/08/2011
Idade : 69
Localização : Rio de Janeiro, RJ, Itabuna-Ilhéus, BA, Brasil
 Re: Ligações químicas
Re: Ligações químicas
Valeu rihan, ficou extremamente bom.

Pedro Prado- Mestre Jedi

- Mensagens : 553
Data de inscrição : 05/06/2015
Idade : 23
Localização : Rio de Janeiro - RJ - Brasil
rihan- Estrela Dourada

- Mensagens : 5049
Data de inscrição : 22/08/2011
Idade : 69
Localização : Rio de Janeiro, RJ, Itabuna-Ilhéus, BA, Brasil
 Tópicos semelhantes
Tópicos semelhantes» Ligações químicas - Estrutura e ligações do NO2
» Ligações Químicas
» Ligações químicas
» Ligações químicas
» Ligações Químicas
» Ligações Químicas
» Ligações químicas
» Ligações químicas
» Ligações Químicas
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|













