ENEM 2° aplicação
3 participantes
PiR2 :: Química :: Físico-Química
Página 1 de 1
 ENEM 2° aplicação
ENEM 2° aplicação
O urânio é um elemento cujos átomos contêm 92 prótons, 92 elétrons e entre 135 e 148 nêutrons. O isótopo de urânio 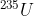 é utilizado como combustível em usinas nucleares, onde, ao ser bombardeado por nêutrons, sofre fissão de seu núcleo e libera uma grande quantidade de energia (
é utilizado como combustível em usinas nucleares, onde, ao ser bombardeado por nêutrons, sofre fissão de seu núcleo e libera uma grande quantidade de energia (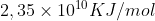 ). O isótopo
). O isótopo 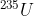 ocorre naturalmente em minérios de urânio, com concentração de apenas 0,7%. Para ser utilizado na geração de energia nuclear, o minério é submetido a um processo de enriquecimento, visando aumentar a concentração do isótopo
ocorre naturalmente em minérios de urânio, com concentração de apenas 0,7%. Para ser utilizado na geração de energia nuclear, o minério é submetido a um processo de enriquecimento, visando aumentar a concentração do isótopo 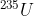 para, aproximadamente, 3% nas pastilhas. Em décadas anteriores, houve um movimento mundial para aumentar a geração de energia nuclear buscando substituir, parcialmente, a geração de energia elétrica a partir da queima do carvão, o que diminui a emissão atmosférica de CO2 (gás com massa molar igual a 44 g/mol).
para, aproximadamente, 3% nas pastilhas. Em décadas anteriores, houve um movimento mundial para aumentar a geração de energia nuclear buscando substituir, parcialmente, a geração de energia elétrica a partir da queima do carvão, o que diminui a emissão atmosférica de CO2 (gás com massa molar igual a 44 g/mol).
A queima do carvão é representada pela equação química:
~+~O_{2}~(g)\rightarrow&space;CO_{2}~(g)~~~~\Delta&space;H=-400KJ/mol)
Qual é a massa de CO2, em toneladas, que deixa de ser liberada na atmosfera, para cada 100 g de pastilhas de urânio enriquecido utilizadas em substituição ao carvão como fonte de energia?
A queima do carvão é representada pela equação química:
Qual é a massa de CO2, em toneladas, que deixa de ser liberada na atmosfera, para cada 100 g de pastilhas de urânio enriquecido utilizadas em substituição ao carvão como fonte de energia?
- Spoiler:
- 33,0
shady17- Jedi

- Mensagens : 322
Data de inscrição : 23/05/2013
Idade : 33
Localização : Uberlândia MG
 Re: ENEM 2° aplicação
Re: ENEM 2° aplicação
1° passo) Uma pastilha de 100 g tem 3 % de minério de urânio, 3 g por pastilha.
2° passo) A massa molar do urânio é 235, ou seja 235 g/mol, então em 3 g temos 3/235 mol.
3° passo) Multiplicamos pela energia 2,35*10^10*3/325 = 3*10^8 kJ
4° passo) 1 mol de CO2 libera 400 kJ, então dividindo 3*10^8 kJ por 400 kJ, obtemos o número de mol, que é 750000 mol. Multiplicamos por 44 g para saber a quantidade de massa, que é 44*750000 = 33000000 g = 33 toneladas.
2° passo) A massa molar do urânio é 235, ou seja 235 g/mol, então em 3 g temos 3/235 mol.
3° passo) Multiplicamos pela energia 2,35*10^10*3/325 = 3*10^8 kJ
4° passo) 1 mol de CO2 libera 400 kJ, então dividindo 3*10^8 kJ por 400 kJ, obtemos o número de mol, que é 750000 mol. Multiplicamos por 44 g para saber a quantidade de massa, que é 44*750000 = 33000000 g = 33 toneladas.
Última edição por Matheus José em Sáb 16 Jan 2016, 17:40, editado 1 vez(es) (Motivo da edição : Correção)

Matheus José- Mestre Jedi

- Mensagens : 630
Data de inscrição : 29/10/2015
Idade : 26
Localização : Santos
 Re: ENEM 2° aplicação
Re: ENEM 2° aplicação
Obrigado amigo.
shady17- Jedi

- Mensagens : 322
Data de inscrição : 23/05/2013
Idade : 33
Localização : Uberlândia MG
 Re: ENEM 2° aplicação
Re: ENEM 2° aplicação
Apenas um cuidado na escrita de símbolos de unidades e prefixos :
O símbolo do prefixo quilo é k (minúsculo)
Além disso, pela legislação brasileira (e internacional) é obrigatório o uso de espaço entre o número e o símbolo:
100 g , 3 g , 3 % , 235 g/mol , 3.108 kJ , 400 kJ , 44 g
O símbolo do prefixo quilo é k (minúsculo)
Além disso, pela legislação brasileira (e internacional) é obrigatório o uso de espaço entre o número e o símbolo:
100 g , 3 g , 3 % , 235 g/mol , 3.108 kJ , 400 kJ , 44 g

Elcioschin- Grande Mestre

- Mensagens : 73174
Data de inscrição : 15/09/2009
Idade : 78
Localização : Santos/SP
 Re: ENEM 2° aplicação
Re: ENEM 2° aplicação
Corrigido Elcio. Obrigado por avisar =]

Matheus José- Mestre Jedi

- Mensagens : 630
Data de inscrição : 29/10/2015
Idade : 26
Localização : Santos
PiR2 :: Química :: Físico-Química
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












