Eletrons
2 participantes
Página 1 de 1
 Eletrons
Eletrons
Quais dos seguintes átomos nos estados fundamentais devem ser paramagnéticos:
a) Na(Z=11)
b) Ca(Z=20)
c) Se(Z=34)
a) Na(Z=11)
b) Ca(Z=20)
c) Se(Z=34)
invertor- Recebeu o sabre de luz

- Mensagens : 100
Data de inscrição : 29/08/2014
Idade : 27
Localização : parna - Paraná - Br
 Re: Eletrons
Re: Eletrons
Observe a distribuição eletrônica dos elementos em seus estados fundamentais:
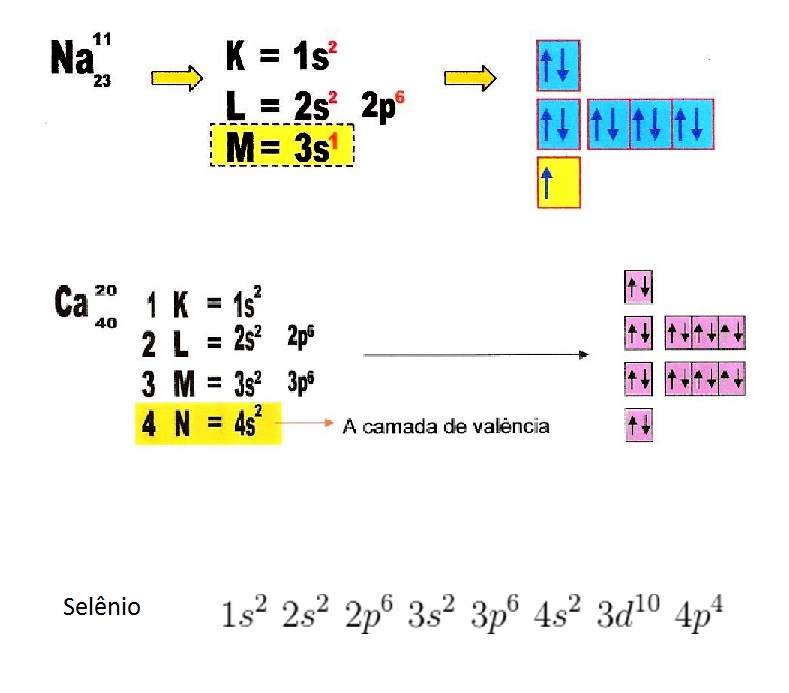
Observe que apenas o Na não tem todos os seus elétrons emparelhados, tendo em seu orbital 3s um elétron sozinho. O que faz o elemento ser paramagnético é a disponibilidade de elétrons que alinham seu spin com o campo magnético externo. Quando todos os elétron estão emparelhados em pares, o spin de um elétron cancela com o de outro, impedindo que ocorra o alinhamento com o campo magnético. Teoricamente, o sódio é o único paramagnético.
Mas como muitas coisas na química, existem exceções. Conforme Z vai aumentando, a carga efetiva (Zef) que os elétrons sentem aumenta também, só que de maneira diferente para cada orbital. No caso do cálcio, com a adição de um próton, o orbital 3d sente um aumento de Zef maior que o do orbital 4s, de forma que as energias desses orbitais se aproximem. Feito isso, acontece dos elétrons do orbital 4s irem para o 3d e assim passarem a existir elétrons desemparelhados. Então, o cálcio também é considerado paramagnético.
Dê uma lida nessas referências:
https://socratic.org/questions/is-calcium-paramagnetic-or-diamagnetic-and-why
http://chemistry.stackexchange.com/questions/33297/why-do-3d-orbitals-have-lesser-energy-than-4s-orbitals-in-transition-metals

Observe que apenas o Na não tem todos os seus elétrons emparelhados, tendo em seu orbital 3s um elétron sozinho. O que faz o elemento ser paramagnético é a disponibilidade de elétrons que alinham seu spin com o campo magnético externo. Quando todos os elétron estão emparelhados em pares, o spin de um elétron cancela com o de outro, impedindo que ocorra o alinhamento com o campo magnético. Teoricamente, o sódio é o único paramagnético.
Mas como muitas coisas na química, existem exceções. Conforme Z vai aumentando, a carga efetiva (Zef) que os elétrons sentem aumenta também, só que de maneira diferente para cada orbital. No caso do cálcio, com a adição de um próton, o orbital 3d sente um aumento de Zef maior que o do orbital 4s, de forma que as energias desses orbitais se aproximem. Feito isso, acontece dos elétrons do orbital 4s irem para o 3d e assim passarem a existir elétrons desemparelhados. Então, o cálcio também é considerado paramagnético.
Dê uma lida nessas referências:
https://socratic.org/questions/is-calcium-paramagnetic-or-diamagnetic-and-why
http://chemistry.stackexchange.com/questions/33297/why-do-3d-orbitals-have-lesser-energy-than-4s-orbitals-in-transition-metals

gabrieldpb- Fera

- Mensagens : 284
Data de inscrição : 08/02/2016
Idade : 29
Localização : Ribeirão Preto
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|













