UEFS 2014
3 participantes
Página 1 de 1
 UEFS 2014
UEFS 2014
A mudança do estado sólido para o estado líquido e desse para o estado sólido é denominada processo de fusão ou de congelamento, dependendo do sentido em que acontecem as mudanças. Nesses processos, ocorre consumo ou perda de energia.
A) O ponto de fusão da água aumenta com o crescimento da pressão.
B) A água gelada no interior de uma garrafa fechada chega a se solidificar quando a garrafa é aberta, porque a pressão no interior diminui até a representada em um ponto situado na região correspondente ao estado sólido.
C) Impurezas solúveis presentes na água, à pressão atmosférica, não causam modificações no ponto de fusão e de congelamento da água.
D) O consumo e a perda de quantidade de energia durante o processo de mudança de estado físico da água de sólido para líquido e deste para sólido possuem valores numéricos relativos iguais.
E) Os patinadores deslizam com facilidade sobre o gelo porque, após exercer pressão sobre este, transforma-o em líquido, estado físico em que permanece.
Gabarito : B Qual o erro da A ? O que altera o ponto de fusão ? Eu sei que o aumento da pressão faz aumentar o ponto de ebulição, mas o de fusão não ?E na D, qual o erro ?
APSmed- Mestre Jedi

- Mensagens : 580
Data de inscrição : 21/04/2014
Idade : 27
Localização : Bahia
 Re: UEFS 2014
Re: UEFS 2014
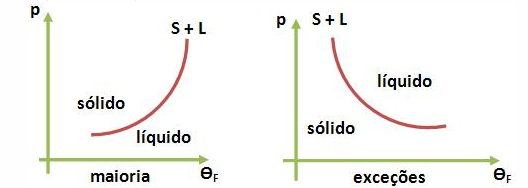
Olhando para os gráficos acima podemos observar que para as exceções ( H20 , Fe, Bi, Sb) , a fusão tem por objetivo diminuir o volume de cada uma delas , portanto quando a pressão aumenta o volume tende a diminuir o volume de cada uma delas . Logo , para as exceções , se a pressão aumentar , ela irá favorecer a fusão , diminuindo assim a temperatura de fusão .
A energia de uma substância é sua entalpia .
Fusão = processo endotérmico
Água no estado líquido e sólido ( entalpias )
H2(g) + 1/2 02 ---- H20(l) entalpia = -285,5 KJ
H2(g) + 1/2 02 ---- H20(s) entalpia = -292,6 KJ
H20 (s)---- H20 (?) , como H2 e 02 são iguais a zero , podemos concluir que os valores das variações da entalpia dada nas reações é igual a dos produtos
Hfusão = (-292,6-(-285,5) = +7 kJ , fazendo o processo inverso fica -7KJ
Obs: São iguais , só muda o sinal porque um é processo exotérmico e o outro endotérmico

Luan Henrique Silva Melo- Jedi

- Mensagens : 348
Data de inscrição : 29/06/2016
Idade : 26
Localização : Lages/SC
 Re: UEFS 2014
Re: UEFS 2014
Então por que a D está errada, Luan, se os valores números são iguais (7kj)?
joaoop- Iniciante
- Mensagens : 27
Data de inscrição : 07/04/2016
Idade : 23
Localização : Feira de Santana, Bahia, Brasil
 Re: UEFS 2014
Re: UEFS 2014
joaoop escreveu:Então por que a D está errada, Luan, se os valores números são iguais (7kj)?
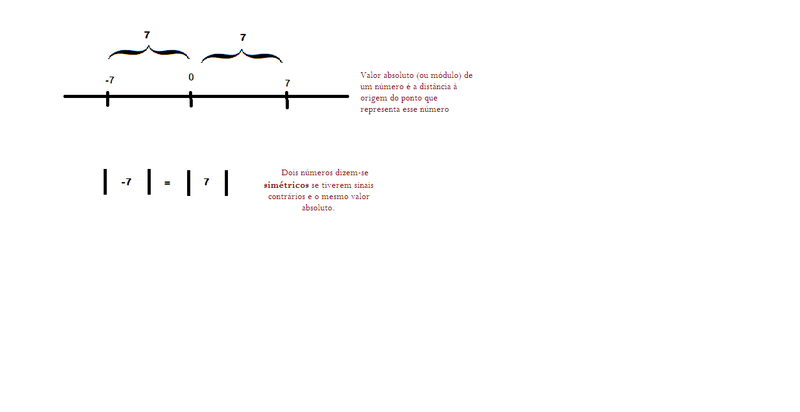
Não são valores relativos iguais .São números absolutos , pois em módulo apresentam o mesmo valor . A distância de 7 a 0 é igual a distância de -7 a 0 . Podemos falar também que são simétricos , pois tem sinais contrários e o mesmo valor absoluto .

Luan Henrique Silva Melo- Jedi

- Mensagens : 348
Data de inscrição : 29/06/2016
Idade : 26
Localização : Lages/SC
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|













