(UFPR) Equilíbrio Químico
2 participantes
PiR2 :: Química :: Físico-Química
Página 1 de 1
 (UFPR) Equilíbrio Químico
(UFPR) Equilíbrio Químico
O bicarbonato de sódio é um produto químico de grande importância. Ele possui diversas aplicações, sendo largamente utilizado como antiácido, para neutralizar a acidez estomacal, e como fermento químico, na produção de pães, bolos etc. Nos EUA, a produção industrial do bicarbonato de sódio utiliza o método de extração do mineral Trona. Já no Brasil e vários países da Europa, o bicarbonato de sódio é produzido industrialmente pelo Processo Solvay, um dos poucos processos industriais não catalíticos. Esse processo consiste em duas etapas. Na primeira, a salmoura é saturada com amônia. Na segunda, injeta-se gás carbônico na salmoura saturada, o que provoca a precipitação do bicarbonato de sódio. As duas etapas podem ser descritas pelas duas equações a seguir:
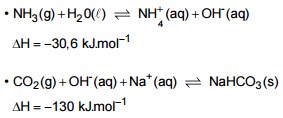
Sobre essas etapas, responda:
A) Por que se adiciona amônia na primeira etapa do processo?
B) Utilizando as informações fornecidas e os conceitos do Princípio de Le Chatelier, que condições experimentais de temperatura e pressão favorecerão maior eficiência do processo nas duas etapas?
Gostaria de tirar uma dúvida quanto a letra B. Por ser uma questão discursiva, eu poderia resolvê-la desta maneira:
- Somarei ambas as equações e as suas respectivas entalpias:

Assim, pelo Princípio de Le Chatelier, verifica-se que em um aumento da temperatura do sistema haverá o deslocamento do equilíbrio no sentido de formação de bicarbonato. Também pelo Princípio de Le Chatelier, o aumento da pressão favorece a formação de bicarbonato.
Minha dúvida é somente com relação a parte em que eu somo às equações. Eu posso fazer isso?
Resposta que eu vi na internet:
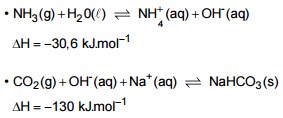
Sobre essas etapas, responda:
A) Por que se adiciona amônia na primeira etapa do processo?
B) Utilizando as informações fornecidas e os conceitos do Princípio de Le Chatelier, que condições experimentais de temperatura e pressão favorecerão maior eficiência do processo nas duas etapas?
Gostaria de tirar uma dúvida quanto a letra B. Por ser uma questão discursiva, eu poderia resolvê-la desta maneira:
- Somarei ambas as equações e as suas respectivas entalpias:

Assim, pelo Princípio de Le Chatelier, verifica-se que em um aumento da temperatura do sistema haverá o deslocamento do equilíbrio no sentido de formação de bicarbonato. Também pelo Princípio de Le Chatelier, o aumento da pressão favorece a formação de bicarbonato.
Minha dúvida é somente com relação a parte em que eu somo às equações. Eu posso fazer isso?
Resposta que eu vi na internet:

Giovana Martins- Grande Mestre

- Mensagens : 7647
Data de inscrição : 15/05/2015
Idade : 23
Localização : São Paulo
 Re: (UFPR) Equilíbrio Químico
Re: (UFPR) Equilíbrio Químico
Não sei bem o que quis dizer com aquele 4 V e 2 V, mas se for para analisar a relação volume/pressão/deslocamento, está errado.
E não, não pode somar as equações, pois simplesmente não faz sentido. Não são etapas consecutivas que formam uma global. São reações independentes.
E não, não pode somar as equações, pois simplesmente não faz sentido. Não são etapas consecutivas que formam uma global. São reações independentes.

Ashitaka- Monitor

- Mensagens : 4365
Data de inscrição : 12/03/2013
Localização : São Paulo
 Re: (UFPR) Equilíbrio Químico
Re: (UFPR) Equilíbrio Químico
Obrigada pela atenção, Ashitaka.
"E não, não pode somar as equações, pois simplesmente não faz sentido. Não são etapas consecutivas que formam uma global. São reações independentes."
Muito obrigada, era isso mesmo que eu queria saber.
Ashitaka, com relação a parte do 4 V e do 2 V, eu utilizei isto para analisar a influência da pressão sobre o equilíbrio químico. Sério que isso está errado O.o? Sempre vi isso nos livros, resoluções de cursinhos etc :scratch: . Sem utilizar esse artifício, como eu poderia analisar a influência da pressão sobre um equilíbrio químico?
"E não, não pode somar as equações, pois simplesmente não faz sentido. Não são etapas consecutivas que formam uma global. São reações independentes."
Muito obrigada, era isso mesmo que eu queria saber.
Ashitaka, com relação a parte do 4 V e do 2 V, eu utilizei isto para analisar a influência da pressão sobre o equilíbrio químico. Sério que isso está errado O.o? Sempre vi isso nos livros, resoluções de cursinhos etc :scratch: . Sem utilizar esse artifício, como eu poderia analisar a influência da pressão sobre um equilíbrio químico?

Giovana Martins- Grande Mestre

- Mensagens : 7647
Data de inscrição : 15/05/2015
Idade : 23
Localização : São Paulo
 Re: (UFPR) Equilíbrio Químico
Re: (UFPR) Equilíbrio Químico
Disponha!
Você está equivocada, pois a análise de volume é feita tendo em vista apenas os entes gasosos. No caso da primeira reação, há 1 mol gasoso no reagente e 0 no produto. O aumento da pressão desloca, portanto, para direita. É assim que se analisa... tem que ver qual lado tem maior número de mol gasoso.
Você está equivocada, pois a análise de volume é feita tendo em vista apenas os entes gasosos. No caso da primeira reação, há 1 mol gasoso no reagente e 0 no produto. O aumento da pressão desloca, portanto, para direita. É assim que se analisa... tem que ver qual lado tem maior número de mol gasoso.

Ashitaka- Monitor

- Mensagens : 4365
Data de inscrição : 12/03/2013
Localização : São Paulo
 Re: (UFPR) Equilíbrio Químico
Re: (UFPR) Equilíbrio Químico
Ah, é mesmo. Preciso revisar a teoria... Estou esquecendo coisas básicas  . Novamente, obrigada.
. Novamente, obrigada.

Giovana Martins- Grande Mestre

- Mensagens : 7647
Data de inscrição : 15/05/2015
Idade : 23
Localização : São Paulo
 Tópicos semelhantes
Tópicos semelhantes» (UFPR) - Equilíbrio Químico
» NC-UFPR 2020 Equilíbrio químico
» UFPR - Deslocamento de equilíbrio químico
» Equilíbrio químico - grau de equilíbrio
» (NC-UFPR) Constante de Equilíbrio
» NC-UFPR 2020 Equilíbrio químico
» UFPR - Deslocamento de equilíbrio químico
» Equilíbrio químico - grau de equilíbrio
» (NC-UFPR) Constante de Equilíbrio
PiR2 :: Química :: Físico-Química
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|













