Oxirredução
3 participantes
Página 1 de 1
 Oxirredução
Oxirredução
Qual das equações seguintes representa uma reação de oxirredução?
a) Ag+ + I- → AgI
b) Nal → Na+ + l-
c) Ag+ + Na → Na+ + Ag
d) Al3+ + 3 OH- →Al (OH)3
e) HCO3- + H+ → CO2 + H2O
Não entendi bem essa questão. Vocês poderiam, por favor, fazer um comentário em cada alternativa: porque está certo, proque está errado?
a) Ag+ + I- → AgI
b) Nal → Na+ + l-
c) Ag+ + Na → Na+ + Ag
d) Al3+ + 3 OH- →Al (OH)3
e) HCO3- + H+ → CO2 + H2O
Não entendi bem essa questão. Vocês poderiam, por favor, fazer um comentário em cada alternativa: porque está certo, proque está errado?
- Gabarito:
- Letra C

Igor Samuray- Jedi

- Mensagens : 231
Data de inscrição : 26/01/2013
Idade : 29
Localização : Paraná
 Re: Oxirredução
Re: Oxirredução
a) AgI é composto pelos íons Ag^+ + I^- (então não houve variação de número de oxidação, portanto, não foi uma reação de oxirredução);
b) Mesma coisa que a A.
c) Houve variação de número de oxidação (um elétron foi passado do Ag para o Na), portanto, é uma reação e oxirredução.
d) Mesma coisa que a A.
e) Mesma coisa que a A.
b) Mesma coisa que a A.
c) Houve variação de número de oxidação (um elétron foi passado do Ag para o Na), portanto, é uma reação e oxirredução.
d) Mesma coisa que a A.
e) Mesma coisa que a A.
 Re: Oxirredução
Re: Oxirredução
a) Ag+ + I- → AgI
reagentes:
Nox do Ag+: +1
Nox do I-: -1
produtos:
Nox do Ag: +1
Nox do I: -1
Vale lembrar que os elementos da família 17 tem o NOX -1. Neste caso, o I.
Não há redução nem oxidação.
b) Nal → Na+ + l-
reagentes:
Nox do Na: +1
Nox do I: -1
produtos:
Nox do Na+: +1
Nox do I-: -1
Vale lembrar que os elementos da família 1, têm o NOX +1. Neste caso, o Na.
Não há redução nem oxidação.
c) Ag+ + Na → Na+ + Ag
reagentes:
Nox do Ag+: +1
Nox do Na: 0
Vale lembrar que toda substância pura simples (átomos iguais), possui NOX zero.
produtos:
Nox do Na+: +1
Nox do Ag: 0
Ocorre oxidação e redução.
d) Al3+ + 3 OH- →Al (OH)3
reagentes:
Nox do Al3+: +3
Nox do O: -2
Nox do H-: +1
produtos:
Nox do O: -2
Nox do H: +1
Nox do Al: +3
O NOX do Alumínio em substancias compostas é +3, mas dava pra deduzir, veja só:
Na base Al(OH)3, o NOX do Oxigênio é -2, e multiplicando pelo índice 3, temos a carga -6. O Hidrogênio tem carga +1, multiplicando pelo índice 3, temos +3. Sendo assim, a carga da base fica como -3, e para compensar, o NOX do Alumínio deve ser +3.
Não há redução nem oxidação.
e) HCO3- + H+ → CO2 + H2O
ATENÇÃO: na molécula HCO3-, nosso objetivo é chegar no NOX de seu íon, que no caso é -1!!!
reagentes:
Nox do O: -2
Nox do H: +1
perceba que somando as cargas -2 e +1, temos -1, mas nosso objetivo é chegar no NOX do íon, que é -1, logo, o NOX do Carbono será -2.
Nox do C: +4
Nox do H+: +1
produtos:
Nox do O: -2
Nox do C: +4
Nox do O: -2
Nox do H: +1
Não há redução nem oxidação.
Espero ter ajudado!
reagentes:
Nox do Ag+: +1
Nox do I-: -1
produtos:
Nox do Ag: +1
Nox do I: -1
Vale lembrar que os elementos da família 17 tem o NOX -1. Neste caso, o I.
Não há redução nem oxidação.
b) Nal → Na+ + l-
reagentes:
Nox do Na: +1
Nox do I: -1
produtos:
Nox do Na+: +1
Nox do I-: -1
Vale lembrar que os elementos da família 1, têm o NOX +1. Neste caso, o Na.
Não há redução nem oxidação.
c) Ag+ + Na → Na+ + Ag
reagentes:
Nox do Ag+: +1
Nox do Na: 0
Vale lembrar que toda substância pura simples (átomos iguais), possui NOX zero.
produtos:
Nox do Na+: +1
Nox do Ag: 0
Ocorre oxidação e redução.
d) Al3+ + 3 OH- →Al (OH)3
reagentes:
Nox do Al3+: +3
Nox do O: -2
Nox do H-: +1
produtos:
Nox do O: -2
Nox do H: +1
Nox do Al: +3
O NOX do Alumínio em substancias compostas é +3, mas dava pra deduzir, veja só:
Na base Al(OH)3, o NOX do Oxigênio é -2, e multiplicando pelo índice 3, temos a carga -6. O Hidrogênio tem carga +1, multiplicando pelo índice 3, temos +3. Sendo assim, a carga da base fica como -3, e para compensar, o NOX do Alumínio deve ser +3.
Não há redução nem oxidação.
e) HCO3- + H+ → CO2 + H2O
ATENÇÃO: na molécula HCO3-, nosso objetivo é chegar no NOX de seu íon, que no caso é -1!!!
reagentes:
Nox do O: -2
Nox do H: +1
perceba que somando as cargas -2 e +1, temos -1, mas nosso objetivo é chegar no NOX do íon, que é -1, logo, o NOX do Carbono será -2.
Nox do C: +4
Nox do H+: +1
produtos:
Nox do O: -2
Nox do C: +4
Nox do O: -2
Nox do H: +1
Não há redução nem oxidação.
Espero ter ajudado!
Última edição por kogasatatara em Ter 01 Set 2015, 21:10, editado 3 vez(es)
kogasatatara- Recebeu o sabre de luz

- Mensagens : 121
Data de inscrição : 15/06/2015
Idade : 25
Localização : SP
 Re: Oxirredução
Re: Oxirredução
Só reforçando, hehehe:
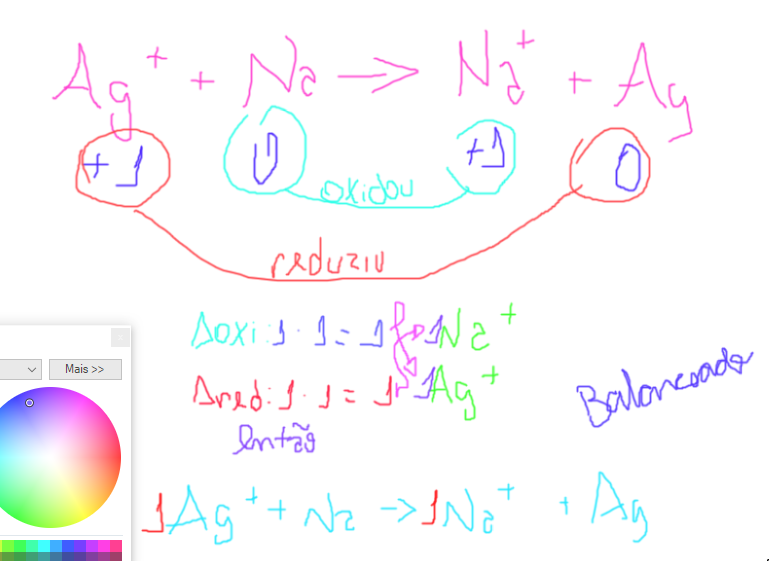
Qualquer dúvida, pergunte.

Qualquer dúvida, pergunte.
kogasatatara- Recebeu o sabre de luz

- Mensagens : 121
Data de inscrição : 15/06/2015
Idade : 25
Localização : SP
 Re: Oxirredução
Re: Oxirredução
Caraca, cara você é d+. Obrigado Kogasatatara, entendi toda a resolução. Valeu mesmo, show de bola. Obrigado também Christian M. Martins.

Igor Samuray- Jedi

- Mensagens : 231
Data de inscrição : 26/01/2013
Idade : 29
Localização : Paraná
 Re: Oxirredução
Re: Oxirredução
Aliás, fiz uma correção na última. Achei que o 3 do HCO3- era do expoente. Corrigi ali, mas de qualquer forma, não oxida nem reduz.Igor Samuray escreveu:Caraca, cara você é d+. Obrigado Kogasatatara, entendi toda a resolução. Valeu mesmo, show de bola. Obrigado também Christian M. Martins.
kogasatatara- Recebeu o sabre de luz

- Mensagens : 121
Data de inscrição : 15/06/2015
Idade : 25
Localização : SP
 Re: Oxirredução
Re: Oxirredução
blz.

Igor Samuray- Jedi

- Mensagens : 231
Data de inscrição : 26/01/2013
Idade : 29
Localização : Paraná
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos













