Quimica
2 participantes
Página 1 de 1
 Quimica
Quimica
02(UDESC SC 2010)Dados os calores de reação das condições padrões para as reações químicas abaixo:
H2(g)+1/2 O2(g)---->H2O(L) ∆H°=-68,3kcal
C(s)+ O2(g)--->CO2 ∆H°=-94,0kcal
c2H2(s)+5/2 O2(g) ---> 2CO2+H2O(L) ∆H°=-310,6kcal
Pode-se afirmar que a entalpia padão do acetileno, em kcal/mol. é:
a)-310,6
b)-222,5
c)-54,3
d)+54,3
e)+222,5
H2(g)+1/2 O2(g)---->H2O(L) ∆H°=-68,3kcal
C(s)+ O2(g)--->CO2 ∆H°=-94,0kcal
c2H2(s)+5/2 O2(g) ---> 2CO2+H2O(L) ∆H°=-310,6kcal
Pode-se afirmar que a entalpia padão do acetileno, em kcal/mol. é:
a)-310,6
b)-222,5
c)-54,3
d)+54,3
e)+222,5
ina- Mestre Jedi

- Mensagens : 602
Data de inscrição : 29/08/2009
Localização : valente
 Re: Quimica
Re: Quimica
1°.Passo montar a equação procurada :
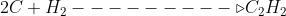
2°Passo manusear as equações dadas:
Manter a 1° : H2(g)+1/2 O2(g)---->H2O(L) ∆H°=-68,3kcal
Multplicar por 2 a 2° equação:
( C(s)+ O2(g)--->CO2 ∆H°=-94,0kcal ) *2
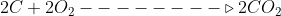
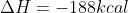
Inverter a equação 3:
2CO2+H2O(L) ----------> C2H2(s)+5/2 O2(g) ∆H°= 310,6kcal
Agora soma as 3 equações :
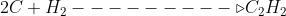
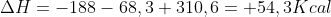
2°Passo manusear as equações dadas:
Manter a 1° : H2(g)+1/2 O2(g)---->H2O(L) ∆H°=-68,3kcal
Multplicar por 2 a 2° equação:
( C(s)+ O2(g)--->CO2 ∆H°=-94,0kcal ) *2
Inverter a equação 3:
2CO2+H2O(L) ----------> C2H2(s)+5/2 O2(g) ∆H°= 310,6kcal
Agora soma as 3 equações :
Bruno Barreto- Mestre Jedi

- Mensagens : 997
Data de inscrição : 23/10/2009
Idade : 34
Localização : Pernambuco
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












