Termoquímica
2 participantes
PiR2 :: Química :: Físico-Química
Página 1 de 1
 Termoquímica
Termoquímica
A redução do óxido de zinco por alumínio metálico é conhecida por aluminotermia, processo que tem como produto final o zinco metálico e o óxido de alumínio correspondente. Sua equação química representativa é:
3 ZnO(s) + 2 Al(s) --> 3 Zn(s) + Al2O3(s)
Dado: Zn=65 g/mol, O=16 g/mol, Al=27 g/mol
Em um dado experimento, foi realizada a aluminotermia de 43,2 g de alumínio metálico. Sabendo que Δ Hf(ZnO) = -348 kJ/mol e Δ Hf(Al2O3) = -1675,7 kJ/mol, é possível determinar que tal experimento irá produzir uma quantidade de energia igual a:
a) 505,36 kJb) 631,7 kJ
c) 1062,16 kJ
d) 1327,7 kJ
e) 2175,76 kJ
Gabarito: A Desde já agradeço
AnaLuC- Iniciante
- Mensagens : 15
Data de inscrição : 01/04/2013
Idade : 28
Localização : JF - MG, Brasil
 Re: Termoquímica
Re: Termoquímica
Δ Hf(ZnO) = -348 kJ/mol --> isso significa que a cada mol de consumo de ZnO, a reação libera um equivalente de energia de 348 kJ
Δ Hf(Al2O3) = -1675,7 kJ/mol --> isso significa que a cada mol de produção de Al2O3, a reação libera um equivalente de energia de 1675,7 kJ
precisamos saber então o número de mol de cara componente para assim determinar suas devidas entalpias, para isso vamos utilizar a quantidade em gramas dada do alumínio, descobrindo seu número de mols, os outros aparecem por estequiometria:
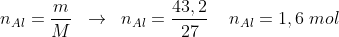
pela estequiometria da reação referente a proporção: 3:2 --> 3:1
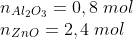
se um mol de Al2O3 libera 1675,7 kJ, 0,8 liberará 1340,56 kJ (regra de 3)
se um mol de ZnO libera 348 kJ, 2,4 liberará 835,2 kJ
\;\;\rightarrow&space;\;\;&space;\Delta&space;E&space;=&space;-505,36\;kJ)
ou seja a reação produzirá (liberará) 505,36 kJ de energia.
Δ Hf(Al2O3) = -1675,7 kJ/mol --> isso significa que a cada mol de produção de Al2O3, a reação libera um equivalente de energia de 1675,7 kJ
precisamos saber então o número de mol de cara componente para assim determinar suas devidas entalpias, para isso vamos utilizar a quantidade em gramas dada do alumínio, descobrindo seu número de mols, os outros aparecem por estequiometria:
pela estequiometria da reação referente a proporção: 3:2 --> 3:1
se um mol de Al2O3 libera 1675,7 kJ, 0,8 liberará 1340,56 kJ (regra de 3)
se um mol de ZnO libera 348 kJ, 2,4 liberará 835,2 kJ
ou seja a reação produzirá (liberará) 505,36 kJ de energia.
____________________________________________
Thálisson.

Thálisson C- Monitor

- Mensagens : 3020
Data de inscrição : 19/02/2014
Idade : 27
Localização : Gurupi -TO
PiR2 :: Química :: Físico-Química
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












