Termodinâmica-05
4 participantes
PiR2 :: Física :: Mecânica dos Fluidos
Página 1 de 1
 Termodinâmica-05
Termodinâmica-05
Um gás ideal, inicialmente a pressão P0 passa por uma expansão livre (adiabática, sem a realização de trabalho externo) até que seu volume final seja de 3 vezes o seu volume inicial. O gás então é lenta e adiabaticamente comprimido de volta a seu volume inicial. A pressão após a compressão é (3,00)^(1/3) P0. Determine se o gás é monoatômico, diatômico ou poliatômico.
- Spoiler:
- Poliatômico, γ = 1,3
Ismael Neto- Padawan

- Mensagens : 95
Data de inscrição : 07/02/2013
Idade : 28
Localização : Rio de Janeiro, RJ
 Re: Termodinâmica-05
Re: Termodinâmica-05
EDITADO
p1 = p0
p2 = 31/3p0
V1 = 3V0
V2 = V0
γ = CP/CV = ?
SOLUÇÃO
Em processos adiabático utilizamos a Equação de Poisson:
p1V1γ = p2V2γ
p0(3V0)γ = 31/3p0V0γ
3γV0γ = 31/3V0γ
3γ = 31/3
γ = 1/3
Encontrando calor específico a volume constante (CV):
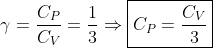
DADOSIsmael Neto escreveu:Um gás ideal, inicialmente a pressão P0 passa por uma expansão livre (adiabática, sem a realização de trabalho externo) até que seu volume final seja de 3 vezes o seu volume inicial. O gás então é lenta e adiabaticamente comprimido de volta a seu volume inicial. A pressão após a compressão é (3,00)^(1/3) P0. Determine se o gás é monoatômico, diatômico ou poliatômico.
- Spoiler:
p1 = p0
p2 = 31/3p0
V1 = 3V0
V2 = V0
γ = CP/CV = ?
SOLUÇÃO
Em processos adiabático utilizamos a Equação de Poisson:
p1V1γ = p2V2γ
p0(3V0)γ = 31/3p0V0γ
3γV0γ = 31/3V0γ
3γ = 31/3
γ = 1/3
Encontrando calor específico a volume constante (CV):
Última edição por aryleudo em Seg 08 Abr 2013, 11:45, editado 2 vez(es)
____________________________________________
"Há três coisas na vida que não voltam: As palavras, o tempo e as oportunidades."
Autor Desconhecido

aryleudo- Grande Mestre

- Mensagens : 2292
Data de inscrição : 01/10/2009
Idade : 41
Localização : Cascavel/CE - Brasil
 Re: Termodinâmica-05
Re: Termodinâmica-05
Assim não estaria mais correto?


Ismael Neto- Padawan

- Mensagens : 95
Data de inscrição : 07/02/2013
Idade : 28
Localização : Rio de Janeiro, RJ
 Re: Termodinâmica-05
Re: Termodinâmica-05
Coloquei "γ = 1,3" porque achei que você tivesse informado errado o valor da p2 (pressão 2).
Então no caso fica:
p1V1γ = p2V2γ
p0(3V0)γ = 31/3p0V0γ
3γV0γ = 31/3V0γ
3γ = 31/3
γ = 1/3
Então no caso fica:
p1V1γ = p2V2γ
p0(3V0)γ = 31/3p0V0γ
3γV0γ = 31/3V0γ
3γ = 31/3
γ = 1/3
____________________________________________
"Há três coisas na vida que não voltam: As palavras, o tempo e as oportunidades."
Autor Desconhecido

aryleudo- Grande Mestre

- Mensagens : 2292
Data de inscrição : 01/10/2009
Idade : 41
Localização : Cascavel/CE - Brasil
 Re: Termodinâmica-05
Re: Termodinâmica-05
Mestre, p1 não seria 1/3 porque o volume triplicou, sem a realização de trabalho?
Ismael Neto- Padawan

- Mensagens : 95
Data de inscrição : 07/02/2013
Idade : 28
Localização : Rio de Janeiro, RJ
 Re: Termodinâmica-05
Re: Termodinâmica-05
Tem razão!!!
Considerei o volume inicial após a expansão livre (V1 = V0).
Considerei o volume inicial após a expansão livre (V1 = V0).
____________________________________________
"Há três coisas na vida que não voltam: As palavras, o tempo e as oportunidades."
Autor Desconhecido

aryleudo- Grande Mestre

- Mensagens : 2292
Data de inscrição : 01/10/2009
Idade : 41
Localização : Cascavel/CE - Brasil
 Re: Termodinâmica-05
Re: Termodinâmica-05
Ismael
Você postou sua questão erradamente em Termodinâmica.
O correto é Hidrostática e Pressão dos Gases
Vou mudar. Por favor poste corretamente nas próximas vezes
Você postou sua questão erradamente em Termodinâmica.
O correto é Hidrostática e Pressão dos Gases
Vou mudar. Por favor poste corretamente nas próximas vezes

Elcioschin- Grande Mestre

- Mensagens : 73186
Data de inscrição : 15/09/2009
Idade : 78
Localização : Santos/SP
 Re: Termodinâmica-05
Re: Termodinâmica-05
P1 = p0/3
V1 = 3v0
P2 = 3^1/3p0
V2 = v0
Montando a equação encontra-se y = 4/3 que é um gás poliatômico.
V1 = 3v0
P2 = 3^1/3p0
V2 = v0
Montando a equação encontra-se y = 4/3 que é um gás poliatômico.
Felipe moura Molina- Iniciante
- Mensagens : 6
Data de inscrição : 16/01/2017
Idade : 30
Localização : São Paulo
PiR2 :: Física :: Mecânica dos Fluidos
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












