FUVEST 2007 - Reação de oxirredução
2 participantes
Página 1 de 1
 FUVEST 2007 - Reação de oxirredução
FUVEST 2007 - Reação de oxirredução

Olá, amigos! Minhas dúvidas ficaram nesta questão da FUVEST 2007, Química.
Eu não consegui, sozinho, chegar ao resultado. O resultado informado é .
Fiz, portanto, um caminho "reverso" para tentar chegar lá: peguei a resposta e comecei a estudar o que ela poderia me informar. O que encontrei foi que:
- O íon Ag reagiu com o alumínio metálico. O que possibilitou isso foi justamente sua dissociação (seria o termo certo?). Essa portanto foi a reação de oxirredução que levou ao clareamento das colheres.
Entretanto, ficou a seguinte dúvida:
- O íon Ag, portanto, que estava antes com o oxigênio ou enxofre (Ag2O ou Ag2S, conforme no enunciado) sofreu uma dissociação. Foi o bicarbonato que causou? Qual o papel do bicarbonato neste processo todo?
- Se sim, como eu iria reconhecer se o Ag reagiu com o Na do bicarbonato ou com o alumínio? Me surge a dúvida até por ter deduzido, pelo enunciado, que o Na tem maior caráter oxidante.
- O que falta eu aprender ou conhecer pra conseguir solucionar o problema?
Obrigado! Abraços enormes

RenatoLenon- Iniciante
- Mensagens : 8
Data de inscrição : 05/12/2022
Idade : 19
 Re: FUVEST 2007 - Reação de oxirredução
Re: FUVEST 2007 - Reação de oxirredução
RenatoLenon, EXCELENTE a forma que você colocou a sua dúvida, demonstra que você TRABALHOU bastante em cima da questão, vou tentar contribuir de alguma forma:RenatoLenon escreveu:
Olá, amigos! Minhas dúvidas ficaram nesta questão da FUVEST 2007, Química.
Eu não consegui, sozinho, chegar ao resultado. O resultado informado é .
Fiz, portanto, um caminho "reverso" para tentar chegar lá: peguei a resposta e comecei a estudar o que ela poderia me informar. O que encontrei foi que:
- O íon Ag reagiu com o alumínio metálico. O que possibilitou isso foi justamente sua dissociação (seria o termo certo?). Essa portanto foi a reação de oxirredução que levou ao clareamento das colheres.
Entretanto, ficou a seguinte dúvida:
- O íon Ag, portanto, que estava antes com o oxigênio ou enxofre (Ag2O ou Ag2S, conforme no enunciado) sofreu uma dissociação. Foi o bicarbonato que causou? Qual o papel do bicarbonato neste processo todo?
- Se sim, como eu iria reconhecer se o Ag reagiu com o Na do bicarbonato ou com o alumínio? Me surge a dúvida até por ter deduzido, pelo enunciado, que o Na tem maior caráter oxidante.
- O que falta eu aprender ou conhecer pra conseguir solucionar o problema?
Obrigado! Abraços enormes
a) Fiz, portanto, um caminho "reverso" para tentar chegar lá: peguei a resposta e comecei a estudar o que ela poderia me informar. O que encontrei foi que:
- O íon Ag reagiu com o alumínio metálico. O que possibilitou isso foi justamente sua dissociação (seria o termo certo?). Essa portanto foi a reação de oxirredução que levou ao clareamento das colheres.
EXATAMENTE vamos tentar indicar a diferença entre dissociação e ionização:
Dissociação e Ionização
Entenda a diferença entre dissociação iônica e ionização:
Dissociação iônica: É o processo físico de separação de íons que ocorre em sais e bases.
Ionização: É uma reação química que origina íons a partir de ácidos colocados em água.
Fonte: https://www.todamateria.com.br/dissociacao-ionica/
b) Entretanto, ficou a seguinte dúvida:
- O íon Ag, portanto, que estava antes com o oxigênio ou enxofre (Ag2O ou Ag2S, conforme no enunciado) sofreu uma dissociação. Foi o bicarbonato que causou? Qual o papel do bicarbonato neste processo todo?
No processo descrito, as colheres de prata que estavam escurecidas, devido à formação de Ag2O e Ag2S, voltam a ter brilho, pois o íon Ag+ presente nesses compostos se reduz a Ag0. Isso ocorre porque o potencial de redução da prata é maior que o do alumínio presente na colher, que irá se oxidar.
A equação iônica que representa essa reação é:
[latex]3\ Ag^++3\ e^-\rightarrow3Ag^0 [/latex]
Al^0 → Al^3+ + 3 e–
=====================
[latex]3\ Ag^++Al^0\rightarrow3Ag^0+Al^{+3}[/latex]
O Bicarbonato de sódio [NaHCO3] que é um solvente iônico tem a função de facilitar a dissociação dos compostos iônicos Ag2S e AgO (SEMELHANTE dissolve SEMELHANTE):
The Dissolution Process
What occurs at the molecular level to cause a solute to dissolve in a solvent? The answer depends in part on the solute, but there are some similarities common to all solutes.
Recall the rule that like dissolves like. This means that substances must have similar intermolecular forces to form solutions. When a soluble solute is introduced into a solvent, the particles of solute can interact with the particles of solvent. In the case of a solid or liquid solute, the interactions between the solute particles and the solvent particles are so strong that the individual solute particles separate from each other and, surrounded by solvent molecules, enter the solution. (Gaseous solutes already have their constituent particles separated, but the concept of being surrounded by solvent particles still applies.) This process is called solvation and is illustrated in Figure 14.4.114.4.1. When the solvent is water, the word hydration, rather than solvation, is used.
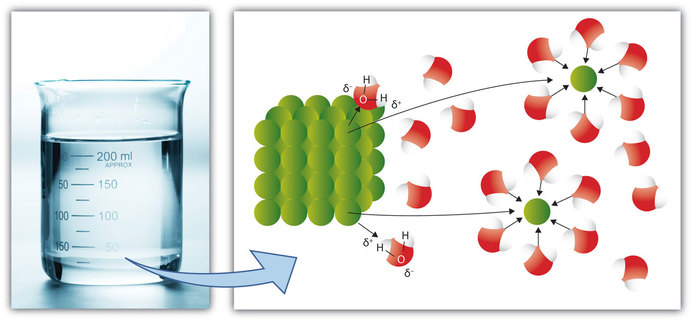
Figure 14.4.114.4.1: Solvation. When a solute dissolves, the individual particles of solute become surrounded by solvent particles. Eventually the particle detaches from the remaining solute, surrounded by solvent molecules in solution. Source: Photo
https://chem.libretexts.org/Courses/Modesto_Junior_College/Chemistry_150_-_Bunag/Textbook_for_Chemistry_150/14%3A_Solutions/14.04%3A_The_Dissolution_Process
c) - Se sim, como eu iria reconhecer se o Ag reagiu com o Na do bicarbonato ou com o alumínio? Me surge a dúvida até por ter deduzido, pelo enunciado, que o Na tem maior caráter oxidante.
- O que falta eu aprender ou conhecer pra conseguir solucionar o problema?
O seu raciocínio está CORRETO, poderíamos ter a seguinte reação de OXIDORREDUÇÃO:
Ag^++e^-→ Ag^0
Na^0 → Na^+ + e–
=====================
Ag^++Na^0→ Ag^0+Na^{+}
POREM......... CONTUDO ........... ENTRETANTO essa reação NÃO está entre as alternativas, então resta apenas a alternativa A
ET = O LATEX começou a falhar por isso tive que improvisar, se não entender alguma que escrevi pode perguntar.





Jigsaw- Monitor

- Mensagens : 772
Data de inscrição : 26/12/2020
Localização : São Paulo/SP
 Tópicos semelhantes
Tópicos semelhantes» Reação de Oxirredução
» Reação de oxirredução (ENEM)
» Pilha e reação de oxirredução
» (CESMAC) Reação de oxirredução
» (unifor-ce) reação de oxirredução
» Reação de oxirredução (ENEM)
» Pilha e reação de oxirredução
» (CESMAC) Reação de oxirredução
» (unifor-ce) reação de oxirredução
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












