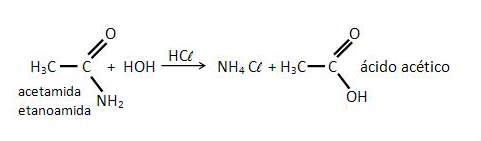Concentração de Íons - Uerj 2022
3 participantes
PiR2 :: Química :: Físico-Química
Página 1 de 1
 Concentração de Íons - Uerj 2022
Concentração de Íons - Uerj 2022
Em testes de perfuração realizados em plataformas de petróleo, pode ser utilizado o brometo de cálcio. Considere um teste para o qual foi preparada uma solução aquosa desse sal na concentração de 3000 g/L. Admitindo a completa dissociação do sal, a concentração de íons brometo, em mol/L, nessa solução, é igual a:
(A) 15
(B) 30
(C) 45
(D) 60
Olá, como deveria fazer essa questão?
Pensei em montar a reação, balancear e comparar os mols porém não bateu com o gabarito o resultado
(A) 15
(B) 30
(C) 45
(D) 60
- GABARITO:
- B
Olá, como deveria fazer essa questão?
Pensei em montar a reação, balancear e comparar os mols porém não bateu com o gabarito o resultado
Última edição por Ana Laura Guimarães em Seg 16 maio 2022, 19:55, editado 1 vez(es)
 Re: Concentração de Íons - Uerj 2022
Re: Concentração de Íons - Uerj 2022
Montando a reação química (dissociação):

Note a proporção de sal para íons brometo 1:2, assim, calculando a quantidade de concentração do sal, basta multiplicar por 2 e estará determinado a concentração de íons brometos dissociados. Logo, como a massa molecular do sal vale 200 g/mol (40 u + 80 u + 80 u):


Note a proporção de sal para íons brometo 1:2, assim, calculando a quantidade de concentração do sal, basta multiplicar por 2 e estará determinado a concentração de íons brometos dissociados. Logo, como a massa molecular do sal vale 200 g/mol (40 u + 80 u + 80 u):
____________________________________________
Dê tempo ao
Lateralus Φ

qedpetrich- Monitor

- Mensagens : 2498
Data de inscrição : 05/07/2021
Idade : 24
Localização : Erechim - RS / Passo Fundo - RS
 Re: Concentração de Íons - Uerj 2022
Re: Concentração de Íons - Uerj 2022
Muito obrigada!!qedpetrich escreveu:Montando a reação química (dissociação):
Note a proporção de sal para íons brometo 1:2, assim, calculando a quantidade de concentração do sal, basta multiplicar por 2 e estará determinado a concentração de íons brometos dissociados. Logo, como a massa molecular do sal vale 200 g/mol (40 u + 80 u + 80 u):
Desculpe a pergunta talvez besta, mas no enunciado diz ser em meio aquoso, porém, na reação a água não aparece, quando eu sei quando ou não considerar a água na reação?
 Re: Concentração de Íons - Uerj 2022
Re: Concentração de Íons - Uerj 2022
Ana Laura Guimarães escreveu:
Desculpe a pergunta talvez besta, mas no enunciado diz ser em meio aquoso, porém, na reação a água não aparece, quando eu sei quando ou não considerar a água na reação?
Ana, existem duas formas de representar o meio aquoso. Uma delas, foi a notação que eu utilizei. Perceba que eu deixei explícito que o brometo de cálcio está dissociado na água pela notação (aq). Esta simbologia representa que o composto iônico está na presença com água. Outra forma, é usar o brometo de cálcio na forma sólida (s). Aí sim, a água evidentemente aparece na reação química:
Os íons estão separados e cercados por moléculas de água; como o símbolo (aq) indica meio aquoso, não é necessário representar a fórmula H2O no lado dos produtos.
____________________________________________
Dê tempo ao
Lateralus Φ

qedpetrich- Monitor

- Mensagens : 2498
Data de inscrição : 05/07/2021
Idade : 24
Localização : Erechim - RS / Passo Fundo - RS
Ana Laura Guimarães gosta desta mensagem
 Re: Concentração de Íons - Uerj 2022
Re: Concentração de Íons - Uerj 2022
Olá, Ana Laura!
Esse exemplo é bem diferente do que o que o @qedpetrich resolveu na questão acima! Isso é uma reação entre um composto orgânico (amida) e água, que ocorre apenas em meio ácido/básico (no caso, a partir da adição de ácido clorídrico numa solução de acetamida e água). Essa adição ocorre, necessariamente, por conta do efeito que o HCl vai causar à solução, permitindo que a acetamida reaja com a água (coisa que não ia acontecer, pois tinha-se um composto apolar e um composto polar) e seja convertida em ácido acético.
Note que a reação da questão trata-se apenas de uma dissolução de um sal em água. Você diz:
Seria algo assim:
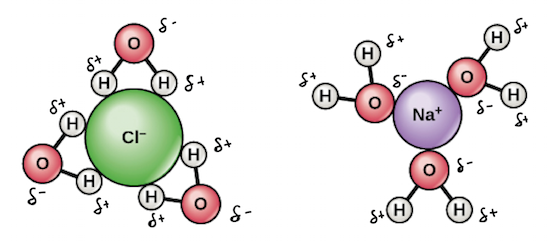
Só que, no lugar do Cl-, seria Br-. E no lugar do Na+, seria Ca+.
Aí, na representação da fórmula, colocamos apenas:

Esse (aq) quer dizer que o cátion/ânion está interagindo com a água.
Deu pra compreender?
Esse exemplo é bem diferente do que o que o @qedpetrich resolveu na questão acima! Isso é uma reação entre um composto orgânico (amida) e água, que ocorre apenas em meio ácido/básico (no caso, a partir da adição de ácido clorídrico numa solução de acetamida e água). Essa adição ocorre, necessariamente, por conta do efeito que o HCl vai causar à solução, permitindo que a acetamida reaja com a água (coisa que não ia acontecer, pois tinha-se um composto apolar e um composto polar) e seja convertida em ácido acético.
Note que a reação da questão trata-se apenas de uma dissolução de um sal em água. Você diz:
Mas, nessa reação, os produtos contém o oxigênio e o hidrogênio da água! É como o @qedpetrich falou, é questão de representação. O cristal do sal vai se dissociar, então os ânions do sal (Br-) irão interagir com a parte "mais positiva" da água, ou seja, os hidrogênios. Já os cátions do sal (Ca+) irão interagir com a parte "mais negativa" da água, ou seja, o oxigênios.Ana Laura Guimarães escreveu:Porém, porque em algumas reações o Hidrogênio e o Oxigênio da água vão para os produtos...
Seria algo assim:

Só que, no lugar do Cl-, seria Br-. E no lugar do Na+, seria Ca+.
Aí, na representação da fórmula, colocamos apenas:
Esse (aq) quer dizer que o cátion/ânion está interagindo com a água.
Deu pra compreender?

Arlindocampos07- Mestre Jedi

- Mensagens : 506
Data de inscrição : 22/02/2022
Idade : 20
Localização : Cajazeiras, Paraíba, Brasil
Ana Laura Guimarães e qedpetrich gostam desta mensagem
 Re: Concentração de Íons - Uerj 2022
Re: Concentração de Íons - Uerj 2022
Muito obrigada pela explicação!!Arlindocampos07 escreveu:Olá, Ana Laura!
Esse exemplo é bem diferente do que o que o @qedpetrich resolveu na questão acima! Isso é uma reação entre um composto orgânico (amida) e água, que ocorre apenas em meio ácido/básico (no caso, a partir da adição de ácido clorídrico numa solução de acetamida e água). Essa adição ocorre, necessariamente, por conta do efeito que o HCl vai causar à solução, permitindo que a acetamida reaja com a água (coisa que não ia acontecer, pois tinha-se um composto apolar e um composto polar) e seja convertida em ácido acético.
Note que a reação da questão trata-se apenas de uma dissolução de um sal em água. Você diz:Mas, nessa reação, os produtos contém o oxigênio e o hidrogênio da água! É como o @qedpetrich falou, é questão de representação. O cristal do sal vai se dissociar, então os ânions do sal (Br-) irão interagir com a parte "mais positiva" da água, ou seja, os hidrogênios. Já os cátions do sal (Ca+) irão interagir com a parte "mais negativa" da água, ou seja, o oxigênios.Ana Laura Guimarães escreveu:Porém, porque em algumas reações o Hidrogênio e o Oxigênio da água vão para os produtos...
Seria algo assim:
Só que, no lugar do Cl-, seria Br-. E no lugar do Na+, seria Ca+.
Aí, na representação da fórmula, colocamos apenas:
Esse (aq) quer dizer que o cátion/ânion está interagindo com a água.
Deu pra compreender?
Como saberei quando considerar essa interação cátion/ânion da água e quando ela irá reagir formando outro composto? Errei essa questão por ter considerado isso nessa reação do CaBr2 na presença de água
Arlindocampos07 gosta desta mensagem
 Re: Concentração de Íons - Uerj 2022
Re: Concentração de Íons - Uerj 2022
Ana, uma dica é olhar pela complexidade da reação. Não sei se você já chegou a ter contato com toda a química (ver reações de todos os tipos: Orgânicas e Inorgânicas), mas, caso você não tenha visto, fique tranquila. Com o tempo, e com o aprendizado, você irá conhecer reações de todos os tipos possíveis, então você saberá identificar isso.
Usando a questão como contextualização, a dissociação de um sal em água é uma das reações mais simples que veremos na química inteira. Portanto, guarde essa análise que te dei acima e nunca se esqueça.
A reação que você propôs em seguida é algo mais complexo. Reações Orgânicas vão ter várias regrinhas e possibilidades (como essas de as amidas só reagirem com água na presença de um meio ácido e/ou básico) que, só estudando o conteúdo, você consegue ir melhorando.
Então, é o treino e a familiarização com as reações que vão te dar esse conhecimento.
Só pra terminar, uma dica (não sei se muito boa), para saber se o composto vai interagir diretamente com a água, é a seguinte: Na grande maioria das reações, a água é produto. Principalmente em reações de oxirredução e ácido-base(neutralização).
Usando a questão como contextualização, a dissociação de um sal em água é uma das reações mais simples que veremos na química inteira. Portanto, guarde essa análise que te dei acima e nunca se esqueça.
A reação que você propôs em seguida é algo mais complexo. Reações Orgânicas vão ter várias regrinhas e possibilidades (como essas de as amidas só reagirem com água na presença de um meio ácido e/ou básico) que, só estudando o conteúdo, você consegue ir melhorando.
Então, é o treino e a familiarização com as reações que vão te dar esse conhecimento.
Só pra terminar, uma dica (não sei se muito boa), para saber se o composto vai interagir diretamente com a água, é a seguinte: Na grande maioria das reações, a água é produto. Principalmente em reações de oxirredução e ácido-base(neutralização).

Arlindocampos07- Mestre Jedi

- Mensagens : 506
Data de inscrição : 22/02/2022
Idade : 20
Localização : Cajazeiras, Paraíba, Brasil
Ana Laura Guimarães gosta desta mensagem
 Re: Concentração de Íons - Uerj 2022
Re: Concentração de Íons - Uerj 2022
Muito obrigada pela ajuda!!Arlindocampos07 escreveu:Ana, uma dica é olhar pela complexidade da reação. Não sei se você já chegou a ter contato com toda a química (ver reações de todos os tipos: Orgânicas e Inorgânicas), mas, caso você não tenha visto, fique tranquila. Com o tempo, e com o aprendizado, você irá conhecer reações de todos os tipos possíveis, então você saberá identificar isso.
Usando a questão como contextualização, a dissociação de um sal em água é uma das reações mais simples que veremos na química inteira. Portanto, guarde essa análise que te dei acima e nunca se esqueça.
A reação que você propôs em seguida é algo mais complexo. Reações Orgânicas vão ter várias regrinhas e possibilidades (como essas de as amidas só reagirem com água na presença de um meio ácido e/ou básico) que, só estudando o conteúdo, você consegue ir melhorando.
Então, é o treino e a familiarização com as reações que vão te dar esse conhecimento.
Só pra terminar, uma dica (não sei se muito boa), para saber se o composto vai interagir diretamente com a água, é a seguinte: Na grande maioria das reações, a água é produto. Principalmente em reações de oxirredução e ácido-base(neutralização).
Arlindocampos07 gosta desta mensagem
 Tópicos semelhantes
Tópicos semelhantes» pH - Uerj 2022
» óxidos - UERJ 2022
» Uerj 2022 - Probabilidade
» íons KCL
» Densidade e propriedade dos líquidos - Uerj 2022
» óxidos - UERJ 2022
» Uerj 2022 - Probabilidade
» íons KCL
» Densidade e propriedade dos líquidos - Uerj 2022
PiR2 :: Química :: Físico-Química
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos