Eletroquímica - Eletrodeposição
2 participantes
PiR2 :: Química :: Físico-Química
Página 1 de 1
 Eletroquímica - Eletrodeposição
Eletroquímica - Eletrodeposição
(UEPG) Uma placa de certo metal M é imersa numa solução aquosa de CuS04. Após um tempo, observa-se a deposição de cobre metálico sobre ela, e ainda, que a solução, inicialmente azul, vai perdendo sua coloração. Sobre esse experimento assinale as alternativas corretas e faça a soma
01) O metal M perde elétrons e forma cátions, que permanecem em solução
02) O metal M é mais nobre que o cobre
04) O metal M sofre oxidação, cedendo elétrons para os cátions Cu2+ da solução
08) O cobre metálico age como oxidante da reação
16) Os cátions sobre Cu2+ reduzem o metal M da placa
CORRETAS: 01, 04, 08
Minha dúvida é na sentença 8. O correto nâo seria dizer que o cátion Cu2+ age como oxidante da reação, pois é ele que se reduz em Cobre metálico?
E a perda da cor é consequência dessa redução, ou da formação do metal M2+?
Obrigado
01) O metal M perde elétrons e forma cátions, que permanecem em solução
02) O metal M é mais nobre que o cobre
04) O metal M sofre oxidação, cedendo elétrons para os cátions Cu2+ da solução
08) O cobre metálico age como oxidante da reação
16) Os cátions sobre Cu2+ reduzem o metal M da placa
CORRETAS: 01, 04, 08
Minha dúvida é na sentença 8. O correto nâo seria dizer que o cátion Cu2+ age como oxidante da reação, pois é ele que se reduz em Cobre metálico?
E a perda da cor é consequência dessa redução, ou da formação do metal M2+?
Obrigado
Enzo _Sergi- Recebeu o sabre de luz

- Mensagens : 102
Data de inscrição : 30/07/2020
Idade : 21
Localização : Porto Alegre, RS, Brasil
 Re: Eletroquímica - Eletrodeposição
Re: Eletroquímica - Eletrodeposição
O  forma à partir da redução, o cobre metálico pela reação:
forma à partir da redução, o cobre metálico pela reação:

E sobre a cor está relacionada ao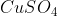 que tem coloração azulada, veja:
que tem coloração azulada, veja:

O sulfato está diminuindo sua conçentração para formação do cobre metálico.
E sobre a cor está relacionada ao
O sulfato está diminuindo sua conçentração para formação do cobre metálico.
Eduardo Rabelo
18.08.2020 20:11:02
Última edição por Eduardo RabeloITA em Ter 18 Ago 2020, 21:16, editado 1 vez(es)

Eduardo Rabelo- Fera

- Mensagens : 638
Data de inscrição : 23/06/2020
Idade : 19
Localização : Curitiba
 Re: Eletroquímica - Eletrodeposição
Re: Eletroquímica - Eletrodeposição
Mas se o Cu metálico se oxida, não seria agente redutor então??
obrigado
obrigado
Enzo _Sergi- Recebeu o sabre de luz

- Mensagens : 102
Data de inscrição : 30/07/2020
Idade : 21
Localização : Porto Alegre, RS, Brasil
 Re: Eletroquímica - Eletrodeposição
Re: Eletroquímica - Eletrodeposição
Você tem razão, eu respondi fazendo outra coisa e me confundi, perdão.
O Cobre sofre redução, esqueça tudo que disse e leia isto:
O cobre de acordo com o enunciado deposita metal e isso ocorre por conta do processo de redução, ou seja, por conta de ele receber carga negativa a placa vai ficar negativa e por conta disso o Cu2+ do CuSO4 irão se dirigir ao cátodo para ficarem netros, veja que os elementos "desejam" ficar neutros. Por conta disso, a concentração do sulfato diminui e a solução perde cor. Repito o Cobre reduz, ficando negativo e assim aumentando sua massa.
O Cobre sofre redução, esqueça tudo que disse e leia isto:
O cobre de acordo com o enunciado deposita metal e isso ocorre por conta do processo de redução, ou seja, por conta de ele receber carga negativa a placa vai ficar negativa e por conta disso o Cu2+ do CuSO4 irão se dirigir ao cátodo para ficarem netros, veja que os elementos "desejam" ficar neutros. Por conta disso, a concentração do sulfato diminui e a solução perde cor. Repito o Cobre reduz, ficando negativo e assim aumentando sua massa.
Eduardo Rabelo
21:08:19 18.08.2020

Eduardo Rabelo- Fera

- Mensagens : 638
Data de inscrição : 23/06/2020
Idade : 19
Localização : Curitiba
PiR2 :: Química :: Físico-Química
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|













