Equilíbrio Térmico e Massas Gasosas
2 participantes
Página 1 de 1
 Equilíbrio Térmico e Massas Gasosas
Equilíbrio Térmico e Massas Gasosas
Num tubo muito fino,com formato circular, existem N massas gasosas iguais ideais,em equilíbrio térmico,separadas por diafragmas não-porosos.A j-ésima ( 1 ≤ j ≤ N ) massa gasosa possui massa Molar Mj e ocupa um ângulo θj.Assim :
a)\;\;\Theta _{j} =\frac{\pi}{2M_{j}\sum ^{N}_{k=1}M_{k}^{-1}}
b) \;\;\Theta _{j} =\frac{2\pi}{M_{j}\sum ^{N}_{k=1}M_{k}^{-1}}
c)\;\;\Theta _{j} =\frac{2\pi}{3M_{j}\sum ^{N}_{k=1}M_{k}^{-1}}
d) \;\;\Theta _{j} =\frac{2\pi}{M_{j}\sum ^{N-1}_{k=1}M_{k}^{-1}}
e) \;\;\Theta _{j} =\frac{2\pi}{M_{j}\sum ^{N+1}_{k=1}M_{k}^{-1}}
Gab.: Diz ser B, mas não entendi como chegar lá..
a)
b)
c)
d)
e)
Gab.: Diz ser B, mas não entendi como chegar lá..
Última edição por Kayo Emanuel Salvino em Sex 07 Dez 2018, 12:23, editado 1 vez(es)
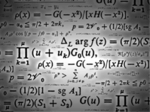
Kayo Emanuel Salvino- Fera

- Mensagens : 589
Data de inscrição : 21/05/2017
Idade : 21
Localização : João Pessoa, Paraíba e Brasil.
 Re: Equilíbrio Térmico e Massas Gasosas
Re: Equilíbrio Térmico e Massas Gasosas
Primeiro, vamos tentar entender o que está acontecendo. Veja a seguinte figura:

Note que cada gás está separado por êmbolos, que o problema chama de diafragma. Como consequência, as pressões dos gases são iguais para que eles possam estar em equilíbrio . Além disso, o problema nos dá que a temperatura dos gases são iguais (equilíbrio térmico), bem como suas massas.
Vamos achar o volume de cada gás em função dos parâmetros do problema, para usarmos a informação de que os gases são ideais. Como o tubo é muito fino, podemos dizer que cada "pedaço" de tubo é um cilindro de área S e altura igual ao comprimento desse "pedaço" de circunferência de raio r. Com isso:
\\V=S.H\\\\V=S.r.\theta
Usando a informação de que os gases são ideais:
\\PV=nRT\\\\P.S.r.\theta=\frac{m}{M}RT\\\\\theta=\frac{mRT}{PSr}.\frac{1}{M}\\\\\theta=k.\frac{1}{M}
Note que k é igual para qualquer um dos gases, de modo que essa expressão vale sempre. Usando essa expressão para o "gás j" e usando ainda que a soma de todos os ângulos é 2π:
\\\begin{cases}\theta_{j}=k.\frac{1}{M_{j}}\\\theta_{1}+\theta_{2}+...+\theta_{N}=2\pi\end{cases}\rightarrow\begin{cases}k=\theta_{j}.M_{j}\\k.(\frac{1}{M_{1}}+\frac{1}{M_{2}}+...+\frac{1}{M_{N}})=2\pi\end{cases}
Substituindo a primeira na segunda:
\\\theta_{j}.M_{j}.(\frac{1}{M_{1}}+\frac{1}{M_{2}}+...+\frac{1}{M_{N}})=2\pi\\\\\theta_{j}=\frac{2\pi}{M_{j}.(\frac{1}{M_{1}}+\frac{1}{M_{2}}+...+\frac{1}{M_{N}})}\\\\\boxed{\theta_{j}=\frac{2\pi}{M_{j}.\sum_{k=1}^{N}(M_{K})^{-1}}}

Note que cada gás está separado por êmbolos, que o problema chama de diafragma. Como consequência, as pressões dos gases são iguais para que eles possam estar em equilíbrio . Além disso, o problema nos dá que a temperatura dos gases são iguais (equilíbrio térmico), bem como suas massas.
Vamos achar o volume de cada gás em função dos parâmetros do problema, para usarmos a informação de que os gases são ideais. Como o tubo é muito fino, podemos dizer que cada "pedaço" de tubo é um cilindro de área S e altura igual ao comprimento desse "pedaço" de circunferência de raio r. Com isso:
Usando a informação de que os gases são ideais:
Note que k é igual para qualquer um dos gases, de modo que essa expressão vale sempre. Usando essa expressão para o "gás j" e usando ainda que a soma de todos os ângulos é 2π:
Substituindo a primeira na segunda:

Victor011- Fera

- Mensagens : 663
Data de inscrição : 21/10/2015
Idade : 26
Localização : Rio de Janeiro, Brasil
 Tópicos semelhantes
Tópicos semelhantes» Equilíbrio Térmico
» (UnB-DF)Equilíbrio Térmico
» Equilíbrio térmico
» Equilíbrio Térmico
» Equilibrio térmico
» (UnB-DF)Equilíbrio Térmico
» Equilíbrio térmico
» Equilíbrio Térmico
» Equilibrio térmico
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












