IME- oxi redução
2 participantes
PiR2 :: Química :: Físico-Química
Página 1 de 1
 IME- oxi redução
IME- oxi redução
o cloro em meio alcalino oxida o iodeto de cromo (III) a cromato e periodato, passando a cloreto.Determine o volume minimo de cloro gasoso medido a 27°C e 1 atm nescessario par converter integralmente 4×10^-3 moles do iodeto.
Não estou conseguindo fazer essas reações ate chegar ao produto final se alguém puder ajudar
Obs: não tenho gabarito essa questao é da prova do ime de 1989
Não estou conseguindo fazer essas reações ate chegar ao produto final se alguém puder ajudar
Obs: não tenho gabarito essa questao é da prova do ime de 1989

Camel- Padawan

- Mensagens : 94
Data de inscrição : 08/01/2017
Idade : 26
Localização : Três Barras do Paraná
 Re: IME- oxi redução
Re: IME- oxi redução
Oi Camel, tudo bem?
Redox em meio básico é sempre bem trabalhoso, mas seguindo alguns passos e treinando um pouco, da para fazer..
Primeiro vou deixar os passos a serem seguidos aqui, caso você não saiba e para ajudar os futuros colegas...
Balancear reações redox em meio básico:
I) Escrever as semi-reações
II) Balancear os átomos, exceto O e H
III) Balancear os oxigênios adicionando H2O
IV) Balancear os hidrogênios adicionando H+
V) Balancear as cargas adicionando elétrons
VI) Deixar o número de elétrons das duas semi-reações iguais e somá-las
VII) Adicionar (OH)- para neutralizar qualquer excesso de H+
Vamos começar:
A reação em questão é:

I) Montar as semi-reações:
\\\\\:&space;.\:&space;\:&space;\:&space;\:&space;\:&space;Cl_2\rightarrow&space;Cl^{-}\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;(reducao))
II) Balancear os átomos exceto O e H:
\\\\\:&space;.\:&space;\:&space;\:&space;\:&space;\:&space;Cl_2\rightarrow&space;{\color{Red}&space;2}Cl^{-}\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;(reducao))
III) Balancear os oxigênios adicionando H2O
\\\\\:&space;.\:&space;\:&space;\:&space;\:&space;\:&space;Cl_2\rightarrow&space;{\color{Red}&space;2}Cl^{-}\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;(reducao))
IV) Balancear os hidrogênios adicionando H+:
\\\\\:&space;.\:&space;\:&space;\:&space;\:&space;\:&space;Cl_2\rightarrow&space;{\color{Red}&space;2}Cl^{-}\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;(reducao))
V) Balancear as cargas adicionando elétrons:
\\\\\:&space;.\:&space;\:&space;\:&space;\:&space;\:&space;Cl_2+{\color{Orange}&space;2e^{-}}\rightarrow&space;{\color{Red}&space;2}Cl^{-}\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;(reducao))
VI) Deixar o número de elétrons das duas semi-reações iguais e somá-las (aqui vamos multiplicar a de oxidação por 2 e a de redução por 27):
\\\\\:&space;.\:&space;\:&space;\:&space;\:&space;\:&space;27Cl_2+{\color{Orange}&space;54e^{-}}\rightarrow&space;{\color{Red}&space;54}Cl^{-}\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;\:&space;(reducao)\\\\.\:&space;\:&space;\:&space;\:&space;\:&space;32H_2O+2CrI_3+27Cl_2\rightarrow&space;2CrO_4^{2-}+6IO_4^{-}+54Cl^{-}+64H^{+})
VII) Adicionar (OH)- para neutralizar qualquer excesso de H+:

Veja que os H+ e os OH- vão reagir formando água. Assim podemos escrever:

Esta é a reação balanceada.
Agora, respondendo a pergunta do problema:
Cálculo da quantidade necessária em mols de Cl2 para consumir 4.10^-3 mols de iodeto:
2 mols CrI3 -------------- 27 mols Cl2
4.10^-3 mols CrI3 -------------- n
n = 54.10^-3 mols de Cl2
Cálculo do volume que 54.10^-3 mols de Cl2 ocupam:
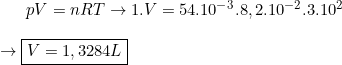
Qualquer dúvida, já sabe!
Um abraço :SW3:
Redox em meio básico é sempre bem trabalhoso, mas seguindo alguns passos e treinando um pouco, da para fazer..
Primeiro vou deixar os passos a serem seguidos aqui, caso você não saiba e para ajudar os futuros colegas...
Balancear reações redox em meio básico:
I) Escrever as semi-reações
II) Balancear os átomos, exceto O e H
III) Balancear os oxigênios adicionando H2O
IV) Balancear os hidrogênios adicionando H+
V) Balancear as cargas adicionando elétrons
VI) Deixar o número de elétrons das duas semi-reações iguais e somá-las
VII) Adicionar (OH)- para neutralizar qualquer excesso de H+
Vamos começar:
A reação em questão é:
I) Montar as semi-reações:
II) Balancear os átomos exceto O e H:
III) Balancear os oxigênios adicionando H2O
IV) Balancear os hidrogênios adicionando H+:
V) Balancear as cargas adicionando elétrons:
VI) Deixar o número de elétrons das duas semi-reações iguais e somá-las (aqui vamos multiplicar a de oxidação por 2 e a de redução por 27):
VII) Adicionar (OH)- para neutralizar qualquer excesso de H+:
Veja que os H+ e os OH- vão reagir formando água. Assim podemos escrever:
Esta é a reação balanceada.
Agora, respondendo a pergunta do problema:
Cálculo da quantidade necessária em mols de Cl2 para consumir 4.10^-3 mols de iodeto:
2 mols CrI3 -------------- 27 mols Cl2
4.10^-3 mols CrI3 -------------- n
n = 54.10^-3 mols de Cl2
Cálculo do volume que 54.10^-3 mols de Cl2 ocupam:
Qualquer dúvida, já sabe!
Um abraço :SW3:
igorrudolf- Jedi

- Mensagens : 434
Data de inscrição : 10/09/2014
Idade : 28
Localização : São Paulo - São Paulo
 Re: IME- oxi redução
Re: IME- oxi redução
Igorrudolf, muito obrigado mesmo resolução perfeita extremamente didática, parabéns! consegui compreender perfeitamente, e desculpe por roubar tanto tempo

Camel- Padawan

- Mensagens : 94
Data de inscrição : 08/01/2017
Idade : 26
Localização : Três Barras do Paraná
PiR2 :: Química :: Físico-Química
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












