FMTM- MG
3 participantes
Página 1 de 1
 FMTM- MG
FMTM- MG
O cloreto de alumínio pode ser produzido a partir de alumínio metálico e gás cloro. A entalpia de reação de formação de 1 mol de AlCl3, calculada a partir das equações termoquímicas dadas, é, em kJ:
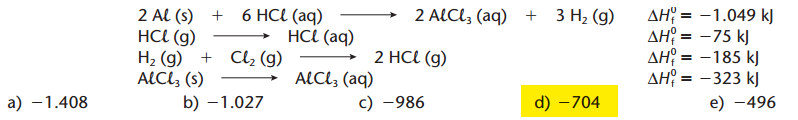
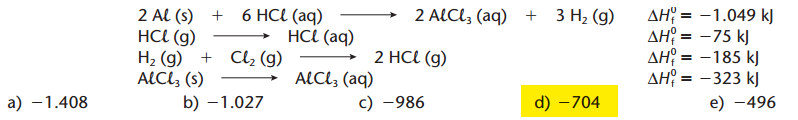
mari- Estrela Dourada

- Mensagens : 1134
Data de inscrição : 01/09/2015
Idade : 26
Localização : São Paulo
Fabinho snow gosta desta mensagem
 Re: FMTM- MG
Re: FMTM- MG
2HCl(g) → 2HCl(aq) .........................................-75*2
H2(g) + Cl2(g) → 2HCl(g) .................................-185
H2(g) + Cl2(g) → 2HCl(aq) ..................................-335
3H2(g) + 3Cl2(g) → 6HCl(aq) ...............................-335*3
2Al(s) + 6HCl(aq) → 2AlCl3(aq) + 3H2(g) ................-1049
2Al(s) + 3Cl2(g) → 2AlCl3(s) ................................-1049-335*3
2Al(s) + 3Cl2(g) → 2AlCl3(s) ................................-1049-335*3
2AlCl3(aq) → 2AlCl3(s) ........................................+323*2
2Al(s) + 3Cl2(g) → 2AlCl3(s) ................................-2054 + 323*2
Para pegar 1 mol divida a última equação por 2. (-2054 + 323*2)/2=-704 kJ
H2(g) + Cl2(g) → 2HCl(g) .................................-185
H2(g) + Cl2(g) → 2HCl(aq) ..................................-335
3H2(g) + 3Cl2(g) → 6HCl(aq) ...............................-335*3
2Al(s) + 6HCl(aq) → 2AlCl3(aq) + 3H2(g) ................-1049
2Al(s) + 3Cl2(g) → 2AlCl3(s) ................................-1049-335*3
2Al(s) + 3Cl2(g) → 2AlCl3(s) ................................-1049-335*3
2AlCl3(aq) → 2AlCl3(s) ........................................+323*2
2Al(s) + 3Cl2(g) → 2AlCl3(s) ................................-2054 + 323*2
Para pegar 1 mol divida a última equação por 2. (-2054 + 323*2)/2=-704 kJ

Matheus José- Mestre Jedi

- Mensagens : 630
Data de inscrição : 29/10/2015
Idade : 26
Localização : Santos
 Re: FMTM- MG
Re: FMTM- MG
Matheus, não consegui entender direito... Pq vc fez todas essas multiplicações? Na verdade eu não consegui compreender em qual equação se quer chegar... 
 Pode dar mais detalhes, por favor?
Pode dar mais detalhes, por favor?
mari- Estrela Dourada

- Mensagens : 1134
Data de inscrição : 01/09/2015
Idade : 26
Localização : São Paulo
 Re: FMTM- MG
Re: FMTM- MG
Sobre as multiplicações, na segunda linha das equações dos exercícios, temos
HCl(g) → HCl(aq) H=-75 kJ (Considere delta H), certo? Você concorda que caso eu dobre a quantidade de HCl gasoso, irei produzir o dobro do HCl aquoso? A variação da entalpia dobra junto.
2HCl(g) → 2HCl(aq) .........................................-75*2
Para chegar nisso:
H2(g) + Cl2(g) → 2HCl(aq) ..................................-335
eu somei as duas equações que a antecedem, que é completamente válido.
Para chegar nisso:
2AlCl3(aq) → 2AlCl3(s) ........................................+323*2
Além de ter dobrado a equação eu a inverti, é necessário inverter o sinal da entalpia também.
O objetivo disso tudo foi chegar em uma forma conveniente:
2Al(s) + 3Cl2(g) → 2AlCl3(s) ................................-2054 + 323*2
Daí dividir por 2 para ter:
Al(s) + 3/2 Cl2(g) → AlCl3(s) ................................[-2054 + 323*2]/2
Entalpia de formação.
Todos os cálculos foram feitos tendo como base na lei de Hess, que afirma que a entalpia depende apenas do estado inicial e final das substâncias.
Observe que nessa minha resolução eu separei em 3 blocos, onde as duas pirmeiras linhas são somadas para formar a terceira.
HCl(g) → HCl(aq) H=-75 kJ (Considere delta H), certo? Você concorda que caso eu dobre a quantidade de HCl gasoso, irei produzir o dobro do HCl aquoso? A variação da entalpia dobra junto.
2HCl(g) → 2HCl(aq) .........................................-75*2
Para chegar nisso:
H2(g) + Cl2(g) → 2HCl(aq) ..................................-335
eu somei as duas equações que a antecedem, que é completamente válido.
Para chegar nisso:
2AlCl3(aq) → 2AlCl3(s) ........................................+323*2
Além de ter dobrado a equação eu a inverti, é necessário inverter o sinal da entalpia também.
O objetivo disso tudo foi chegar em uma forma conveniente:
2Al(s) + 3Cl2(g) → 2AlCl3(s) ................................-2054 + 323*2
Daí dividir por 2 para ter:
Al(s) + 3/2 Cl2(g) → AlCl3(s) ................................[-2054 + 323*2]/2
Entalpia de formação.
Todos os cálculos foram feitos tendo como base na lei de Hess, que afirma que a entalpia depende apenas do estado inicial e final das substâncias.
Observe que nessa minha resolução eu separei em 3 blocos, onde as duas pirmeiras linhas são somadas para formar a terceira.

Matheus José- Mestre Jedi

- Mensagens : 630
Data de inscrição : 29/10/2015
Idade : 26
Localização : Santos
 Re: FMTM- MG
Re: FMTM- MG
Muito obrigada, Matheus 
Bom, deixo ver se entendi... Esse exercício ta difícil pra mim.
Queremos chegar a esta equação ( ) mas tendo como produto somente alumínio e gás cloro :. sem 3H2 (g)
) mas tendo como produto somente alumínio e gás cloro :. sem 3H2 (g)
Tudo que vc fez acima (multiplicações, inversão) foi para "cortar" e no final obter sem o H2, procede?
sem o H2, procede? 
Se sim:
2 HCl (g) → 2 HCl (aq)
H2 (g) + Cl2 (g) → 2 HCl (aq)
2 AlCl3 (aq) → 2AlCl3 (s)
Os marcados em rosa são os que ficam para obter 2Al + 3Cl2→ AlCl3
Agora outra dúvida o 2Cl3 é o mesmo que 3Cl2? Desculpe se a pergunta for bobagem...
Bom, deixo ver se entendi... Esse exercício ta difícil pra mim.
Queremos chegar a esta equação (
 ) mas tendo como produto somente alumínio e gás cloro :. sem 3H2 (g)
) mas tendo como produto somente alumínio e gás cloro :. sem 3H2 (g)Tudo que vc fez acima (multiplicações, inversão) foi para "cortar" e no final obter
 sem o H2, procede?
sem o H2, procede? Se sim:
2 AlCl3 (aq) → 2AlCl3 (s)
Os marcados em rosa são os que ficam para obter 2Al + 3Cl2→ AlCl3
Agora outra dúvida o 2Cl3 é o mesmo que 3Cl2? Desculpe se a pergunta for bobagem...
mari- Estrela Dourada

- Mensagens : 1134
Data de inscrição : 01/09/2015
Idade : 26
Localização : São Paulo
 Re: FMTM- MG
Re: FMTM- MG
Queremos chegar a essa equação: 2Al(s) + 3Cl2(g) → 2AlCl3(s) [E dividimos por 2 para termos 1 mol]mapll escreveu:Queremos chegar a esta equação () mas tendo como produto somente alumínio e gás cloro :. sem 3H2 (g)
Essa equação é a de formação do 2AlCl3(s) considerando o estado dos reagentes em condições normais de temperatura (25°C).
mapll escreveu:Agora outra dúvida o 2Cl3 é o mesmo que 3Cl2? Desculpe se a pergunta for bobagem...
Dúvidas não são bobagens, melhor perguntar do que ficar com a dúvida não é?
Cl2, é o Cl com o 2 menorzinho em baixo.
Isso significa: Cl-Cl, uma ligação entre dois átomos de cloro.
Como o cloro é um halogênio e só faz uma ligação, não existe: Cl3. Ok?
O número da frente indica a quantidade de mol.
Exemplo:
2O3 -> 2 mol de ozônio (O-O-O)
3O2 -> 3 mol de gás oxigênio (O-O)
São substâncias diferentes, mas possuem a mesma quantidade de átomos se levar em conta o número que os antecede (Indica quantidade de mol).

Matheus José- Mestre Jedi

- Mensagens : 630
Data de inscrição : 29/10/2015
Idade : 26
Localização : Santos
 Re: FMTM- MG
Re: FMTM- MG
Certo  Muito obrigada pela paciência, Matheus!
Muito obrigada pela paciência, Matheus!
mari- Estrela Dourada

- Mensagens : 1134
Data de inscrição : 01/09/2015
Idade : 26
Localização : São Paulo
 Re: FMTM- MG
Re: FMTM- MG
Olá,
Gostaria de saber porque no enunciado são colocados os símbolos da entalpia padrão de formação ∆Hƒº, mesmo a reação 1 não sendo a partir das substâncias simples e as reações 2 e 4 indicarem dissoluções?
Definição pelo livro do feltre
''Entalpia (ou calor) padrão de formação de uma substância é a variação de entalpia verificada na formação de 1 mol da substância, apartir das substâncias simples correspondentes, estando todas no estado padrão''.

Gostaria de saber porque no enunciado são colocados os símbolos da entalpia padrão de formação ∆Hƒº, mesmo a reação 1 não sendo a partir das substâncias simples e as reações 2 e 4 indicarem dissoluções?
Definição pelo livro do feltre
''Entalpia (ou calor) padrão de formação de uma substância é a variação de entalpia verificada na formação de 1 mol da substância, apartir das substâncias simples correspondentes, estando todas no estado padrão''.

igorrudolf- Jedi

- Mensagens : 434
Data de inscrição : 10/09/2014
Idade : 28
Localização : São Paulo - São Paulo
 Re: FMTM- MG
Re: FMTM- MG
Bem observado, não sei explicar, talvez seja um erro. Entenda apenas como a variação da entalpia.

Matheus José- Mestre Jedi

- Mensagens : 630
Data de inscrição : 29/10/2015
Idade : 26
Localização : Santos
 Re: FMTM- MG
Re: FMTM- MG
Matheus José escreveu:Bem observado, não sei explicar, talvez seja um erro. Entenda apenas como a variação da entalpia.
Entendo,
Obrigado pelo retorno :bounce:
igorrudolf- Jedi

- Mensagens : 434
Data de inscrição : 10/09/2014
Idade : 28
Localização : São Paulo - São Paulo
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












