Pressão de gases 1
3 participantes
PiR2 :: Física :: Mecânica dos Fluidos
Página 1 de 1
 Pressão de gases 1
Pressão de gases 1
O recipiente A contém um gás ideal à pressão de 5,0 x 10^5 Pa e à temperatura de 300 K. Ele está ligado por um tubo fino (e uma válvula fechada) a um recipiente B, cujo volume é quatro vezes maior que o de A. o recipiente B contém o mesmo gás ideal à pressão de 1,0 x 10^5 Pa e à temperatura de 400 K. A válvula é aberta para que as pressões se igualem, mas a temperatura de cada recipiente é mantida. Qual é a nova pressão nos dois recipientes?
Resp. 2,0 x 10^5 Pa
Resp. 2,0 x 10^5 Pa
Última edição por DiegoOS em Qui 22 Jan 2015, 18:41, editado 2 vez(es)
DiegoOS- Iniciante
- Mensagens : 14
Data de inscrição : 19/01/2015
Idade : 37
Localização : Serra, ES, Brasil
 Re: Pressão de gases 1
Re: Pressão de gases 1
PV=nRT
De A:
500 000 V = n1 R 300
5 000 V/3 = n1 R
De B:
100 000 (4V)=n2 R 400
1 000 V = n2 R
Como os gases vão se misturar, então somamos sua molaridade, e então se manterá constante o volume.
P . 5V= (n1 R + n2 R) . T
P . 5V= (5 000 V/3 + 1 000 V) . T
P = (8 000 / 3) . (T/5)
P = 1600T/3
Como não sabemos a temperatura, resta-nos achar.
Sabe-se que é o mesmo gás, a razão entre A e B é (5 000 /3 ) / (1 000) = 5/3
Portanto, em A tem 5/3 vezes mais moléculas que em B. Portanto, podemos achar a temperatura:
T=( (5/3) . 300 + 1 . 400 )/( (5/3) + 1) = (500 + 400) / (8 / 3) = 2700/8 = 675/2
Substituindo na equação:
P=1 600 T / 3
P=1 600 . (675/2) / 3
P=180 000
P=1,8 x 10^(5) Pa
Acho que é isso, deu um resultado aproximado.
De A:
500 000 V = n1 R 300
5 000 V/3 = n1 R
De B:
100 000 (4V)=n2 R 400
1 000 V = n2 R
Como os gases vão se misturar, então somamos sua molaridade, e então se manterá constante o volume.
P . 5V= (n1 R + n2 R) . T
P . 5V= (5 000 V/3 + 1 000 V) . T
P = (8 000 / 3) . (T/5)
P = 1600T/3
Como não sabemos a temperatura, resta-nos achar.
Sabe-se que é o mesmo gás, a razão entre A e B é (5 000 /3 ) / (1 000) = 5/3
Portanto, em A tem 5/3 vezes mais moléculas que em B. Portanto, podemos achar a temperatura:
T=( (5/3) . 300 + 1 . 400 )/( (5/3) + 1) = (500 + 400) / (8 / 3) = 2700/8 = 675/2
Substituindo na equação:
P=1 600 T / 3
P=1 600 . (675/2) / 3
P=180 000
P=1,8 x 10^(5) Pa
Acho que é isso, deu um resultado aproximado.

Carlos Adir- Monitor

- Mensagens : 2820
Data de inscrição : 27/08/2014
Idade : 28
Localização : Gurupi - TO - Brasil
 Re: Pressão de gases 1
Re: Pressão de gases 1
dá pra fazer assim, a soma de mols em A e em B inicialmente deve ser igual a soma de mols em A e em B depois de aberto a válvula, em cálculos:

Da equação de clapeyron: n = PV/RT
as temperaturas em A e em B não mudam, e a pressão no final é a mesma:
e a equação fica:

simplificando e tirando os denominadores:
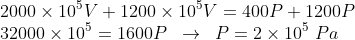
Da equação de clapeyron: n = PV/RT
as temperaturas em A e em B não mudam, e a pressão no final é a mesma:
e a equação fica:
simplificando e tirando os denominadores:
____________________________________________
Thálisson.

Thálisson C- Monitor

- Mensagens : 3020
Data de inscrição : 19/02/2014
Idade : 27
Localização : Gurupi -TO
 Re: Pressão de gases 1
Re: Pressão de gases 1
Ah, ai foi meu erro, considerar o equilibrio térmico. Se considerarmos que não houve equilibrio, então realmente dá 2x10^5 Pa
____________________________________________
← → ↛  ⇌ ⇔ ⇐ ⇒ ⇏ ➥
⇌ ⇔ ⇐ ⇒ ⇏ ➥
 ⇌ ⇔ ⇐ ⇒ ⇏ ➥
⇌ ⇔ ⇐ ⇒ ⇏ ➥⁰ ¹ ² ³ ⁴ ⁵ ⁶ ⁷ ⁸ ⁹ ⁺ ⁻ ⁼ ⁽ ⁾ º ª ⁿ ⁱ
₀ ₁ ₂ ₃ ₄ ₅ ₆ ₇ ₈ ₉ ₊ ₋ ₌ ₍ ₎ ₐ ₑ ₒ ₓ ₔ
∴ ≈ ≠ ≡ ≢ ≤ ≥ × ± ∓ ∑ ∏ √ ∛ ∜ ∝ ∞
∀ ∃ ∈ ∉ ⊂ ⊄ ⋂ ⋃ ∧ ∨ ℝ ℕ ℚ ℤ ℂ
⊥ ║ ∡ ∠ ∢ ⊿ △ □ ▭ ◊ ○ ∆ ◦ ⊙ ⊗ ◈
Αα Ββ Γγ Δδ Εε Ζζ Ηη Θθ Ιι Κκ Λλ Μμ Νν Ξξ Οο Ππ Ρρ Σσς Ττ Υυ Φφ Χχ Ψψ Ωω ϑ ϒ ϖ ƒ ij ℓ
∫ ∬ ∭ ∳ ∂ ∇
 ℛ ℜ ℰ ℳ ℊ ℒ
ℛ ℜ ℰ ℳ ℊ ℒ
Carlos Adir- Monitor

- Mensagens : 2820
Data de inscrição : 27/08/2014
Idade : 28
Localização : Gurupi - TO - Brasil
PiR2 :: Física :: Mecânica dos Fluidos
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|













