Equilíbrio Iônico (IME)
2 participantes
PiR2 :: Química :: Físico-Química
Página 1 de 1
 Equilíbrio Iônico (IME)
Equilíbrio Iônico (IME)
Juntam-se 90ml de solução 0,1 molar de hidróxido de amônio com 10ml de solução 0,1molar de acido clorídrico. Determinar o PH da solução obtida (expressão logarítimica).
Dados: constante de basicidade do amoníaco em agua Kb=1,8x[latex]10^{-5}[/latex]
resposta: [latex]PH= 10+ log1,44[/latex]
Dados: constante de basicidade do amoníaco em agua Kb=1,8x[latex]10^{-5}[/latex]
resposta: [latex]PH= 10+ log1,44[/latex]
Última edição por daniel r em Dom 12 Dez 2021, 12:07, editado 1 vez(es)

daniel r- Iniciante
- Mensagens : 20
Data de inscrição : 30/09/2020
 Re: Equilíbrio Iônico (IME)
Re: Equilíbrio Iônico (IME)
Olá, tudo bem?
Preciso que você perceba que se trata de uma solução tampão.
HCl é um ácido forte. Logo, ele será neutralizado totalmente pela solução de Hidróxido de Amônio.
Número de mols de Hidróxido de Amônio:
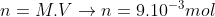
Número de mols de HCl:
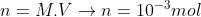
Reação de Neutralização:

Pela proporção estequiométrica e, como o HCl é o reagente limitante, serão consumidos 10^(-3) mol de NH4OH.
Assim, a concentração final de NH4OH será de:
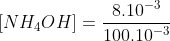
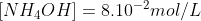
Concentração final do sal:
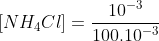
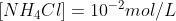
Assim, para a ionização da base restante:

Observe que, como os sais de amônio são solúveis, o NH4Cl estará totalmente dissociado. Logo, a concentração dos íons NH4+ será, aproximadamente, igual à do sal.
Assim:
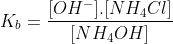
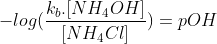
Mas:

Então:




Espero ter ajudado! Grande Abraço!
Preciso que você perceba que se trata de uma solução tampão.
HCl é um ácido forte. Logo, ele será neutralizado totalmente pela solução de Hidróxido de Amônio.
Número de mols de Hidróxido de Amônio:
Número de mols de HCl:
Reação de Neutralização:
Pela proporção estequiométrica e, como o HCl é o reagente limitante, serão consumidos 10^(-3) mol de NH4OH.
Assim, a concentração final de NH4OH será de:
Concentração final do sal:
Assim, para a ionização da base restante:
Observe que, como os sais de amônio são solúveis, o NH4Cl estará totalmente dissociado. Logo, a concentração dos íons NH4+ será, aproximadamente, igual à do sal.
Assim:
Mas:
Então:
Espero ter ajudado! Grande Abraço!
Última edição por FocoNoITA em Dom 12 Dez 2021, 11:10, editado 1 vez(es)

FocoNoIMEITA- Jedi

- Mensagens : 270
Data de inscrição : 05/05/2020
Idade : 21
Localização : Rio de Janeiro-RJ
 Re: Equilíbrio Iônico (IME)
Re: Equilíbrio Iônico (IME)
Eu posso estar me confundindo, mas o amoníaco, composto cujo Kb é dado do enunciado, não seria o NH3? Caso seja mesmo eu posso presumir que a questão esta errada? Sua solução fez bastante sentido para mim. Desde já agradeço.FocoNoITA escreveu:Olá, tudo bem?
Preciso que você perceba que se trata de uma solução tampão.
HCl é um ácido forte. Logo, ele será neutralizado totalmente pela solução de Hidróxido de Amônio.
Número de mols de Hidróxido de Amônio:
Número de mols de HCl:
Reação de Neutralização:
Pela proporção estequiométrica e, como o HCl é o reagente limitante, serão consumidos 10^(-3) mol de NH4OH.
Assim, a concentração final de NH4OH será de:
Concentração final do sal:
Assim, para a ionização da base restante:
Observe que, como os sais de amônio são solúveis, o NH4Cl estará totalmente dissociados. Logo, a concentração dos íons NH4+ será, aproximadamente, igual à do sal.
Assim:
Mas:
Então:
Espero ter ajudado! Grande Abraço!

daniel r- Iniciante
- Mensagens : 20
Data de inscrição : 30/09/2020
 Re: Equilíbrio Iônico (IME)
Re: Equilíbrio Iônico (IME)
Acredito que, pelo fato do enunciado ter mencionado "amoníaco em água", podemos interpretar que se trata de NH3(aq), ou seja, NH4OH.

FocoNoIMEITA- Jedi

- Mensagens : 270
Data de inscrição : 05/05/2020
Idade : 21
Localização : Rio de Janeiro-RJ
 Tópicos semelhantes
Tópicos semelhantes» Equilíbrio Iônico x Equilíbrio Heterogêneo
» equilibrio ionico
» Equilíbrio Iônico
» Equilíbrio Iônico
» Equilíbrio Iônico
» equilibrio ionico
» Equilíbrio Iônico
» Equilíbrio Iônico
» Equilíbrio Iônico
PiR2 :: Química :: Físico-Química
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|













