Geometria Molecular
4 participantes
Página 1 de 1
 Geometria Molecular
Geometria Molecular
(Ufrn) O nitrogênio forma vários óxidos binários apresentando diferentes números de oxidação:
NO (gás tóxico), N2O (gás anestésico - hilariante), NO2 (gás avermelhado, irritante), N2O3 (sólido
azul) etc. Esses óxidos são instáveis e se decompõem para formar os gases nitrogênio (N2) e
oxigênio (O2).
O óxido binário (NO2) é um dos principais poluentes ambientais, reagindo com o ozônio atmosférico
(O3) - gás azul, instável - responsável pela filtração da radiação ultravioleta emitida pelo Sol.
Analisando a estrutura do óxido binário NO2, pode-se afirmar que a geometria da molécula e a
última camada eletrônica do átomo central são, respectivamente,
a) angular e completa.
b) linear e incompleta.
c) angular e incompleta.
d) linear e completa.
Galera, travei na hora de tentar encontrar a geometria molecular do NO2. Para encontrar a geometria molecular das moléculas, costumo identificar a quantidade de nuvens eletrônicas e a quantidade de ligantes ao redor do átomo central. Segue abaixo o método que eu utilizo para encontrar a geometria molecular da água, por exemplo.
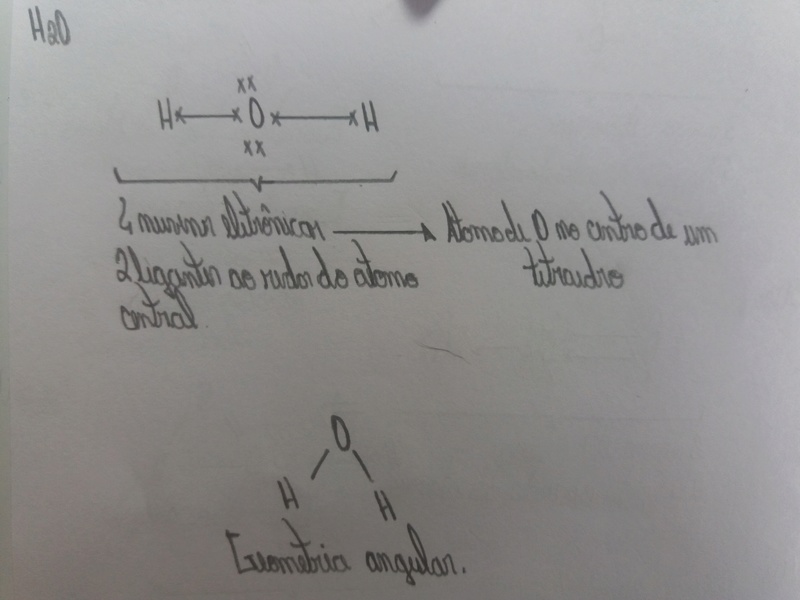
Quando fui utilizar o mesmo método para encontrar a geometria molecular do NO2 eu travei. Comecei estruturando a formula eletrônica dessa maneira:
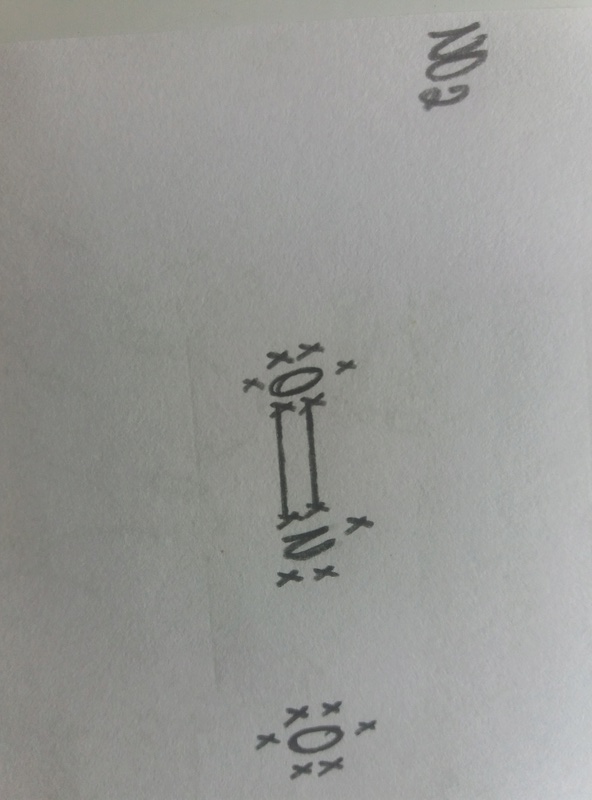
De início, efetuei uma ligação dupla entre o nitrogênio e o carbono da esquerda. O oxigênio se estabilizou, porém o nitrogênio ainda está com 7 elétrons e precisa de mais 1 para se estabilizar. Dai eu pensei em duas coisas:
1ª - Se eu fizer uma ligação dativa, eu vou estabilizar o oxigênio, porém o nitrogênio vai continuar instável.
2ª - Se eu fizer outra dupla ligação, eu vou estabilizar o outro oxigênio, porém eu estaria fazendo 9 ligações com o átomo de nitrogênio.
O que devo fazer ?
NO (gás tóxico), N2O (gás anestésico - hilariante), NO2 (gás avermelhado, irritante), N2O3 (sólido
azul) etc. Esses óxidos são instáveis e se decompõem para formar os gases nitrogênio (N2) e
oxigênio (O2).
O óxido binário (NO2) é um dos principais poluentes ambientais, reagindo com o ozônio atmosférico
(O3) - gás azul, instável - responsável pela filtração da radiação ultravioleta emitida pelo Sol.
Analisando a estrutura do óxido binário NO2, pode-se afirmar que a geometria da molécula e a
última camada eletrônica do átomo central são, respectivamente,
a) angular e completa.
b) linear e incompleta.
c) angular e incompleta.
d) linear e completa.
Galera, travei na hora de tentar encontrar a geometria molecular do NO2. Para encontrar a geometria molecular das moléculas, costumo identificar a quantidade de nuvens eletrônicas e a quantidade de ligantes ao redor do átomo central. Segue abaixo o método que eu utilizo para encontrar a geometria molecular da água, por exemplo.

Quando fui utilizar o mesmo método para encontrar a geometria molecular do NO2 eu travei. Comecei estruturando a formula eletrônica dessa maneira:

De início, efetuei uma ligação dupla entre o nitrogênio e o carbono da esquerda. O oxigênio se estabilizou, porém o nitrogênio ainda está com 7 elétrons e precisa de mais 1 para se estabilizar. Dai eu pensei em duas coisas:
1ª - Se eu fizer uma ligação dativa, eu vou estabilizar o oxigênio, porém o nitrogênio vai continuar instável.
2ª - Se eu fizer outra dupla ligação, eu vou estabilizar o outro oxigênio, porém eu estaria fazendo 9 ligações com o átomo de nitrogênio.
O que devo fazer ?
lucasconrado- Jedi

- Mensagens : 262
Data de inscrição : 13/07/2016
Idade : 32
Localização : RJ
 Re: Geometria Molecular
Re: Geometria Molecular
Alguém ?
lucasconrado- Jedi

- Mensagens : 262
Data de inscrição : 13/07/2016
Idade : 32
Localização : RJ
 Re: Geometria Molecular
Re: Geometria Molecular
Também tenho muitas dúvidas sobre este assunto, pois, é uma exceção a regra do octeto, neste caso o nitrogênio estabilizará com 7 elétrons, pois, geralmente em compostos radioativos há exceções ao octeto. Seu primeiro pensamento está correto de fazer a dativa, o Nitrogênio estará estabilizado com 7 elétrons então pode ficar tranquilo fazendo a dativa que o Nitrogênio ficará bem !(hehe)
Sua geometria será Linear e seu orbital ficará incompleto.
Sua geometria será Linear e seu orbital ficará incompleto.

Oziel- Estrela Dourada

- Mensagens : 1517
Data de inscrição : 26/04/2016
Idade : 25
Localização : São Pedro da Aldeia-RJ
 Re: Geometria Molecular
Re: Geometria Molecular
Obrigado, Oziel. Eu imaginei que pudesse ser mais uma dessas exceções que a química nos proporciona ! Hahahahaha
lucasconrado- Jedi

- Mensagens : 262
Data de inscrição : 13/07/2016
Idade : 32
Localização : RJ
 Re: Geometria Molecular
Re: Geometria Molecular
ERRADO!
A resposta certa é C
A resposta certa é C

be_osc- Jedi

- Mensagens : 315
Data de inscrição : 05/06/2017
Idade : 22
Localização : Salvador, Bahia, Brasil.
 Re: Geometria Molecular
Re: Geometria Molecular
Pessoal, acredito que seja realmente uma exceção à regra do octeto e podemos verificar isso através da carga formal (aconselho a assistirem aos videos do Khan Academy) do Nitrogênio.
A equação da carga formal é dada por
Cf= V-(L+ 1/2 S), onde
V= Número de elétrons na camada de valência
L= Número de elétrons não ligantes
S= Número de elétrons ligantes
O objetivo sempre é ter carga formal igual a zero.
Assim ao montarmos a estrutura de NO2, temos que:
1° Somar a quantidade de elétrons disponíveis na camada de valência dos elementos analisados
2° Identificar o átomo central (geralmente o mais eletronegativo)
3° Realizar as ligações simples (sigmas) com os elementos secundários
4° Distribuir os elétrons restantes nos átomos, dando prioridade aos átomos secundários (considere que cada ligação covalente sigma ocupa dois elétrons).
Pois bem, no caso no NO2 temos 17 elétrons (N=5e e 2O=12e) e ao seguirmos os passos:
A primeira ligação (veja até a última) ficará assim:

Usamos nela 4e (em vermelho) e portanto teremos mais 13e para colocar nos átomos restantes. Como devemos dar prioridade aos secundários, temos:

Ao preencher a camada de valência do Oxigênio, percebemos que foram apenas 12e (em verde). Assim, restará 1e, o qual irá para o Nitrogênio. Esse elétron gerará uma carga negativa, que irá repelir os outros elétrons da ligação do oxigênio

Agora perceba que todos os elétrons disponíveis foram utilizados. Mas o Nitrogênio está com a camada incompleta, ou melhor, com a carga formal diferente de zero. Use a equação e você verá isso, ou a deixe de lado e siga a dica abaixo:

É prático você fazer um circulo em torno do elemento no qual você quer realizar os estudos da carga formal. Aqui você vê a equação de uma forma mais clara. Vamos lá, note que temos 3e no Nitrogênio quanto que para sua carga formal deveríamos ter 5e, igual a camada do seu átomo livre. Portanto, ocorre uma ligação dativa vinda do Oxigênio, o qual "empresta" seus elétrons à camada de valência do Nitrogênio. Veja abaixo:

Veja que agora temos 5 elétrons em nossa circunferência, e isso, no cálculo da carga formal, será igual a zero e a ligação torna-se mais estável. As ligações dativas vindas do oxigênio criarão uma ressonância, e elas devem ser representadas por linhas tracejadas. Abaixo está a representação da molécula:

Peço perdão se eu estiver equivocado ou tenha contribuído para uma confusão em seu aprendizado. Ressalto que os itens aqui apresentados são de extrema necessidade para uma compreensão mais lógica das ligações química.
Fiquem bem.
A equação da carga formal é dada por
Cf= V-(L+ 1/2 S), onde
V= Número de elétrons na camada de valência
L= Número de elétrons não ligantes
S= Número de elétrons ligantes
O objetivo sempre é ter carga formal igual a zero.
Assim ao montarmos a estrutura de NO2, temos que:
1° Somar a quantidade de elétrons disponíveis na camada de valência dos elementos analisados
2° Identificar o átomo central (geralmente o mais eletronegativo)
3° Realizar as ligações simples (sigmas) com os elementos secundários
4° Distribuir os elétrons restantes nos átomos, dando prioridade aos átomos secundários (considere que cada ligação covalente sigma ocupa dois elétrons).
Pois bem, no caso no NO2 temos 17 elétrons (N=5e e 2O=12e) e ao seguirmos os passos:
A primeira ligação (veja até a última) ficará assim:
Usamos nela 4e (em vermelho) e portanto teremos mais 13e para colocar nos átomos restantes. Como devemos dar prioridade aos secundários, temos:
Ao preencher a camada de valência do Oxigênio, percebemos que foram apenas 12e (em verde). Assim, restará 1e, o qual irá para o Nitrogênio. Esse elétron gerará uma carga negativa, que irá repelir os outros elétrons da ligação do oxigênio
Agora perceba que todos os elétrons disponíveis foram utilizados. Mas o Nitrogênio está com a camada incompleta, ou melhor, com a carga formal diferente de zero. Use a equação e você verá isso, ou a deixe de lado e siga a dica abaixo:
É prático você fazer um circulo em torno do elemento no qual você quer realizar os estudos da carga formal. Aqui você vê a equação de uma forma mais clara. Vamos lá, note que temos 3e no Nitrogênio quanto que para sua carga formal deveríamos ter 5e, igual a camada do seu átomo livre. Portanto, ocorre uma ligação dativa vinda do Oxigênio, o qual "empresta" seus elétrons à camada de valência do Nitrogênio. Veja abaixo:
Veja que agora temos 5 elétrons em nossa circunferência, e isso, no cálculo da carga formal, será igual a zero e a ligação torna-se mais estável. As ligações dativas vindas do oxigênio criarão uma ressonância, e elas devem ser representadas por linhas tracejadas. Abaixo está a representação da molécula:
Peço perdão se eu estiver equivocado ou tenha contribuído para uma confusão em seu aprendizado. Ressalto que os itens aqui apresentados são de extrema necessidade para uma compreensão mais lógica das ligações química.
Fiquem bem.
Serafola- Iniciante
- Mensagens : 3
Data de inscrição : 26/05/2020
 Tópicos semelhantes
Tópicos semelhantes» Geometria Molecular
» Geometria Molecular
» Geometria molecular
» Geometria Molecular
» Geometria molecular
» Geometria Molecular
» Geometria molecular
» Geometria Molecular
» Geometria molecular
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|













