Propriedades Coligativas
4 participantes
PiR2 :: Química :: Físico-Química
Página 1 de 1
 Propriedades Coligativas
Propriedades Coligativas
(UFRGS-RS) Uma solução aquosa diluída de sacarose é posta em contato com igual volume de uma
solução aquosa diluída de cloreto de sódio, através de uma membrana semipermeável, resultando no
equilíbrio representado abaixo.
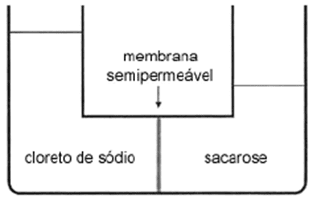
A observação da figura permite afirmar que
a) a pressão osmótica da solução de sacarose é maior que a da solução de cloreto de sódio.
b) a molaridade da solução de cloreto de sódio é maior que a da solução de sacarose.
c) a solução de cloreto de sódio possui temperatura de ebulição inferior à da solução de sacarose.
d) ambas as soluções, quando se encontrarem na mesma temperatura, apresentarão a mesma
pressão de vapor.
e) a solução de cloreto de sódio possui temperatura de congelação inferior à da solução de sacarose
- A questão se refere às soluções antes da mistura, certo?
- Se sim, por que a alternativa B está errada?
Meu raciocínio:
solução aquosa diluída de cloreto de sódio, através de uma membrana semipermeável, resultando no
equilíbrio representado abaixo.

A observação da figura permite afirmar que
a) a pressão osmótica da solução de sacarose é maior que a da solução de cloreto de sódio.
b) a molaridade da solução de cloreto de sódio é maior que a da solução de sacarose.
c) a solução de cloreto de sódio possui temperatura de ebulição inferior à da solução de sacarose.
d) ambas as soluções, quando se encontrarem na mesma temperatura, apresentarão a mesma
pressão de vapor.
e) a solução de cloreto de sódio possui temperatura de congelação inferior à da solução de sacarose
- Gabarito:
- Alternativa E.
- A questão se refere às soluções antes da mistura, certo?
- Se sim, por que a alternativa B está errada?
Meu raciocínio:
Para o NaCl:
Molaridade = m/MV
Molaridade = m/M (pois V é igual para a sacarose, então pode ser desconsiderado)
Como M de NaCl é menor, e sabe-se que m é maior do que a de sacarose (em via da hipertonicidade), a Molaridade será maior do que a de sacarose.
Para a sacarose:
Molaridade = m/MV
Molaridade = m/M
Como M de sacarose é maior, e sabe-se que m é menor que a de NaCl (em via da hipotonicidade), a Molaridade será menor do que a de cloreto de sódio.
Molaridade = m/MV
Molaridade = m/M (pois V é igual para a sacarose, então pode ser desconsiderado)
Como M de NaCl é menor, e sabe-se que m é maior do que a de sacarose (em via da hipertonicidade), a Molaridade será maior do que a de sacarose.
Para a sacarose:
Molaridade = m/MV
Molaridade = m/M
Como M de sacarose é maior, e sabe-se que m é menor que a de NaCl (em via da hipotonicidade), a Molaridade será menor do que a de cloreto de sódio.
 Re: Propriedades Coligativas
Re: Propriedades Coligativas
A figura representa um equilíbrio, portanto a concentração dos dois componentes são iguais.
Entretanto, como o cloreto de sódio é iônico, apresentará um maior efeito criométrico.
Entretanto, como o cloreto de sódio é iônico, apresentará um maior efeito criométrico.
____________________________________________
Thálisson.

Thálisson C- Monitor

- Mensagens : 3020
Data de inscrição : 19/02/2014
Idade : 27
Localização : Gurupi -TO
 Re: Propriedades Coligativas
Re: Propriedades Coligativas
Sim, a concentração dos dois componentes é igual.
Mas a alternativa B fala sobre molaridade.
Por serem de massas molares diferentes, a molaridade vai ser diferente. Ex:
Ambos tem concentração 10g/L
Supondo massa molar do NaCl 30g/mol: 10/30 = 0,3
Supondo massa molar da sacarose 100g/mol: 10/100 = 0,1
São molaridades diferentes com a mesma concentração.
Mas a alternativa B fala sobre molaridade.
Por serem de massas molares diferentes, a molaridade vai ser diferente. Ex:
Ambos tem concentração 10g/L
Supondo massa molar do NaCl 30g/mol: 10/30 = 0,3
Supondo massa molar da sacarose 100g/mol: 10/100 = 0,1
São molaridades diferentes com a mesma concentração.
 Re: Propriedades Coligativas
Re: Propriedades Coligativas
No caso, é a concentração molar mesmo que é igual.
____________________________________________
Thálisson.

Thálisson C- Monitor

- Mensagens : 3020
Data de inscrição : 19/02/2014
Idade : 27
Localização : Gurupi -TO
 Re: Propriedades Coligativas
Re: Propriedades Coligativas
Entendi. Só mais uma dúvida então:
(Pressão Osmótica).V = n.R.T
A dedução de que as duas soluções possuem molalidades/molaridades iguais parte do fato de que para estarem em equilíbrio (exercendo uma mesma pressão osmótica) a um mesmo volume e uma mesma temperatura, elas NECESSITAM de mesma concentração molar?
(Pressão Osmótica).V = n.R.T
A dedução de que as duas soluções possuem molalidades/molaridades iguais parte do fato de que para estarem em equilíbrio (exercendo uma mesma pressão osmótica) a um mesmo volume e uma mesma temperatura, elas NECESSITAM de mesma concentração molar?

Thálisson C- Monitor

- Mensagens : 3020
Data de inscrição : 19/02/2014
Idade : 27
Localização : Gurupi -TO
 Re: Propriedades Coligativas
Re: Propriedades Coligativas
Sim, era o que eu tinha dito. Só queria confirmar se era isso.
Valeu, Thálisson!
Valeu, Thálisson!
 Re: Propriedades Coligativas
Re: Propriedades Coligativas
Tem algo de errado com essa questão. Desconsiderando R e T das equações, vamos analisar:
(Pressão Osmótica) = (Molaridade) * (Coeficiente de Van't Hoff)
Como as pressões osmóticas são iguais no equilíbrio osmótico:
(Molaridade de sacarose)*1 = (Molaridade de NaCl)*2
(Molaridade de sacarose)/2 = (Molaridade de NaCl)
Se a molaridade de NaCl é a metade da molaridade de sacarose, a molaridade do primeiro multiplicado pelo seu coeficiente de Van't Hoff será igual à molaridade do segundo, o que prova que a intensidade das propriedades coligativas de ambas as soluções são iguais.
Onde estou errando?
(Pressão Osmótica) = (Molaridade) * (Coeficiente de Van't Hoff)
Como as pressões osmóticas são iguais no equilíbrio osmótico:
(Molaridade de sacarose)*1 = (Molaridade de NaCl)*2
(Molaridade de sacarose)/2 = (Molaridade de NaCl)
Se a molaridade de NaCl é a metade da molaridade de sacarose, a molaridade do primeiro multiplicado pelo seu coeficiente de Van't Hoff será igual à molaridade do segundo, o que prova que a intensidade das propriedades coligativas de ambas as soluções são iguais.
Onde estou errando?
 Re: Propriedades Coligativas
Re: Propriedades Coligativas
Christian M , o item b fala sobre molalidade,que é diferente de molaridade. MOLALIDADE = (Número de mols do soluto)/(massa do solvente em kg).
E o que garante propriedades coligativas iguais não é o produto da MOLARIDADE pelo coeficiente,mas sim o produto da MOLALIDADE pelo coeficiente.
E o que garante propriedades coligativas iguais não é o produto da MOLARIDADE pelo coeficiente,mas sim o produto da MOLALIDADE pelo coeficiente.
Tiagocbr- Iniciante
- Mensagens : 1
Data de inscrição : 02/02/2017
Idade : 24
Localização : Fortaleza Ceará Brasil
 Re: Propriedades Coligativas
Re: Propriedades Coligativas
Christian
Nesse último post , pra mim , você conseguiu provar que a b está errada.
pelo que sei , propriedade coligativa é única e exclusiva função da quantidade de partículas.
Nesse último post , pra mim , você conseguiu provar que a b está errada.
pelo que sei , propriedade coligativa é única e exclusiva função da quantidade de partículas.

Matheus Tsilva- Fera

- Mensagens : 1240
Data de inscrição : 16/07/2015
Idade : 26
Localização : Uberaba, MG
 Tópicos semelhantes
Tópicos semelhantes» Propriedades Coligativas
» Propriedades coligativas
» Propriedades coligativas
» Propriedades coligativas
» Propriedades coligativas
» Propriedades coligativas
» Propriedades coligativas
» Propriedades coligativas
» Propriedades coligativas
PiR2 :: Química :: Físico-Química
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos













