Propriedades coligativas
2 participantes
PiR2 :: Química :: Físico-Química
Página 1 de 1
 Propriedades coligativas
Propriedades coligativas
Suponha que você, ao adentrar em um laboratório de química, se depare com três soluções aquosas (1L de água) armazenadas em frascos rotulados contendo as seguintes informações:
Frasco 01: solução aquosa de hidróxido de sódio.
Frasco 02: solução aquosa de glicose.
Frasco 03: solução aquosa de cloreto de cálcio.
Supondo que os três frascos apresentem massas iguais de soluto, analise as informações dispostas no enunciado e assinale a alternativa correta.
A-O frasco 02 é o que apresenta maior temperatura de ebulição do solvente
B-Os frascos 01 e 03 apresentam os mesmos efeitos coligativos.
C-O frasco 01 apresenta menor temperatura de congelamento do solvente.
D-Por sofrer ionização, a glicose presente no frasco 02 apresentará 0,01mol L-1 de íons em solução aquosa.
E-Nos três recipientes a pressão máxima de vapor é a mesma
GABARITO C
Quem tem a maior quantidade de mols não é o frasco 3? então ele não deveria ter a menor temperatura de congelamento, menor pressão de vapor e maior temperatura de ebulição?
Frasco 01: solução aquosa de hidróxido de sódio.
Frasco 02: solução aquosa de glicose.
Frasco 03: solução aquosa de cloreto de cálcio.
Supondo que os três frascos apresentem massas iguais de soluto, analise as informações dispostas no enunciado e assinale a alternativa correta.
A-O frasco 02 é o que apresenta maior temperatura de ebulição do solvente
B-Os frascos 01 e 03 apresentam os mesmos efeitos coligativos.
C-O frasco 01 apresenta menor temperatura de congelamento do solvente.
D-Por sofrer ionização, a glicose presente no frasco 02 apresentará 0,01mol L-1 de íons em solução aquosa.
E-Nos três recipientes a pressão máxima de vapor é a mesma
GABARITO C
Quem tem a maior quantidade de mols não é o frasco 3? então ele não deveria ter a menor temperatura de congelamento, menor pressão de vapor e maior temperatura de ebulição?
med01- Padawan

- Mensagens : 91
Data de inscrição : 18/11/2021
 Re: Propriedades coligativas
Re: Propriedades coligativas
Olá med01;
De fato, o recipiente 03 possui menor temperatura de congelamento do solvente, entretanto, como condição, isso só acontecerá se a quantidade de matéria, ou seja, o número de mols for a mesma para todos os frascos. Não é o caso, pois do enunciado temos a suposição de que os três frascos apresentam massas iguais de soluto, assim, você deve fixar uma mesma quantidade de massa não de matéria (n° de mols).
OBS.: Não utilize caixa alta para títulos, isso é utilizado somente para abreviações, ademais, leia as regras do fórum.
De fato, o recipiente 03 possui menor temperatura de congelamento do solvente, entretanto, como condição, isso só acontecerá se a quantidade de matéria, ou seja, o número de mols for a mesma para todos os frascos. Não é o caso, pois do enunciado temos a suposição de que os três frascos apresentam massas iguais de soluto, assim, você deve fixar uma mesma quantidade de massa não de matéria (n° de mols).
OBS.: Não utilize caixa alta para títulos, isso é utilizado somente para abreviações, ademais, leia as regras do fórum.
____________________________________________
Dê tempo ao
Lateralus Φ

qedpetrich- Monitor

- Mensagens : 2498
Data de inscrição : 05/07/2021
Idade : 24
Localização : Erechim - RS / Passo Fundo - RS
 Re: Propriedades coligativas
Re: Propriedades coligativas
Perdão Qedpetrich dessa vez não compreendi totalmente sua resolução. Eu por exemplo posso definir 2 gramas para todos os compostos, e daí achar a quantidade de mols pela fórmula n= massa/massa molar e assim resolver a questão, isso que você quis dizer?
Se sim, nesse caso porque eu não poderia realizar a dissociação da base e do sal e ver a quantidade de mols que eles formam igual em outras questões de coligativas?
Ex: NaOH----- Na+ + OH- = 2 mols
CaCl2------ Ca+ + 2 Cl- = 3 mols
Desculpa a longa pergunta, desde já agradeço.
Se sim, nesse caso porque eu não poderia realizar a dissociação da base e do sal e ver a quantidade de mols que eles formam igual em outras questões de coligativas?
Ex: NaOH----- Na+ + OH- = 2 mols
CaCl2------ Ca+ + 2 Cl- = 3 mols
Desculpa a longa pergunta, desde já agradeço.
med01- Padawan

- Mensagens : 91
Data de inscrição : 18/11/2021
 Re: Propriedades coligativas
Re: Propriedades coligativas
"Eu por exemplo posso definir 2 gramas para todos os compostos, e daí achar a quantidade de mols pela fórmula n= massa/massa molar e assim resolver a questão, isso que você quis dizer?"
Exatamente isso, fixamos uma quantidade de massa qualquer, por exemplo, uma generalização é tomar m.
"Se sim, nesse caso porque eu não poderia realizar a dissociação da base e do sal e ver a quantidade de mols que eles formam igual em outras questões de coligativas? "
É esse o caminho, mas o que você está fazendo é comparar uma mesma quantidade de matéria, não de massa, veja:
1 mol de NaOH dissociado, produz 2 mols de espécies iônicas.
1 mol de CaCl2 dissociado, produz 3 mols de espécies iônicas.
NÃO devemos comparar um mesmo número de QUANTIDADE DE MATÉRIA (n° de mols), aqui estamos fixando 1 mol de NaOH e 1 mol de CaCl2, isso vai contra o comando da questão! Utiliza-se a QUANTIDADE DE MASSA para efeito comparativo.
Um possível caminho:

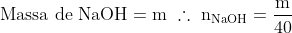
Assim, o frasco 01, produz (m/20) mols de espécies iônicas.

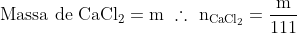
Portanto, o frasco 03, produz (m/37) mols de espécies iônicas.
Conclusão: Tanto o efeito da ebulioscopia quanto a decorrência da crioscopia (no caso da questão) são proporcionais à molalidade de soluto em solução. Assim, fica claro que (m/20) > (m/37), ou seja, a quantidade de espécies químicas dissociadas na solução 01 é maior que a quantidade de espécies químicas dissociadas na solução 03, logo, o frasco 01 apresenta menor temperatura de congelamento do solvente. Conseguiu entender?
Exatamente isso, fixamos uma quantidade de massa qualquer, por exemplo, uma generalização é tomar m.
"Se sim, nesse caso porque eu não poderia realizar a dissociação da base e do sal e ver a quantidade de mols que eles formam igual em outras questões de coligativas? "
É esse o caminho, mas o que você está fazendo é comparar uma mesma quantidade de matéria, não de massa, veja:
1 mol de NaOH dissociado, produz 2 mols de espécies iônicas.
1 mol de CaCl2 dissociado, produz 3 mols de espécies iônicas.
NÃO devemos comparar um mesmo número de QUANTIDADE DE MATÉRIA (n° de mols), aqui estamos fixando 1 mol de NaOH e 1 mol de CaCl2, isso vai contra o comando da questão! Utiliza-se a QUANTIDADE DE MASSA para efeito comparativo.
Um possível caminho:
Assim, o frasco 01, produz (m/20) mols de espécies iônicas.
Portanto, o frasco 03, produz (m/37) mols de espécies iônicas.
Conclusão: Tanto o efeito da ebulioscopia quanto a decorrência da crioscopia (no caso da questão) são proporcionais à molalidade de soluto em solução. Assim, fica claro que (m/20) > (m/37), ou seja, a quantidade de espécies químicas dissociadas na solução 01 é maior que a quantidade de espécies químicas dissociadas na solução 03, logo, o frasco 01 apresenta menor temperatura de congelamento do solvente. Conseguiu entender?
____________________________________________
Dê tempo ao
Lateralus Φ

qedpetrich- Monitor

- Mensagens : 2498
Data de inscrição : 05/07/2021
Idade : 24
Localização : Erechim - RS / Passo Fundo - RS
 Re: Propriedades coligativas
Re: Propriedades coligativas
Agora eu entendi!!! Muito obrigada! Tenho muita dificuldade nesse assunto, mas aos poucos fazendo questões fará mais sentido 

med01- Padawan

- Mensagens : 91
Data de inscrição : 18/11/2021
 Tópicos semelhantes
Tópicos semelhantes» Propriedades Coligativas
» Propriedades coligativas
» Propriedades coligativas
» Propriedades coligativas
» Propriedades coligativas
» Propriedades coligativas
» Propriedades coligativas
» Propriedades coligativas
» Propriedades coligativas
PiR2 :: Química :: Físico-Química
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












