Estequiometria
2 participantes
Página 1 de 1
 Estequiometria
Estequiometria
O íon fosfato, presente nos esgotos descarregados
em rios e lagoas, afeta os ecossistemas aquáticos,
ocasionando desequilíbrio ambiental. Por isso, as
estações de tratamento de esgoto mais modernas
utilizam um método de remoção do fosfato,
representado pela equação:
PO_{4}.6H_{2}O)
Em uma estação de esgoto cuja capacidade de
processamento de fosfato é de 40.000 m3 de esgoto
bruto por dia, com uma eficiência de 90% no
processo de remoção de fósforo, e considerando
que a concentração média diária de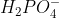 , nas
, nas
medições feitas durante um mês, é de 30 ppm, a
capacidade de produção mensal de
PO_{4}.6H_{2}O) , em quilogramas, será.
, em quilogramas, será.
A) 2,73
B) 3,03.
C) 81,81.
D) 90,90.
E) 3.030,00.
em rios e lagoas, afeta os ecossistemas aquáticos,
ocasionando desequilíbrio ambiental. Por isso, as
estações de tratamento de esgoto mais modernas
utilizam um método de remoção do fosfato,
representado pela equação:
Em uma estação de esgoto cuja capacidade de
processamento de fosfato é de 40.000 m3 de esgoto
bruto por dia, com uma eficiência de 90% no
processo de remoção de fósforo, e considerando
que a concentração média diária de
medições feitas durante um mês, é de 30 ppm, a
capacidade de produção mensal de
A) 2,73
B) 3,03.
C) 81,81.
D) 90,90.
E) 3.030,00.
- Spoiler:
- Gabarito C

Guilherme Mesquita- Jedi

- Mensagens : 301
Data de inscrição : 14/11/2012
Idade : 30
Localização : Santa Inês, Maranhão
 Re: Estequiometria
Re: Estequiometria
Sendo o H2PO4- o solvente, temos:
Concentração = massa de solvente/volume de soluto
30*10^(-6) = m/(40000)
m = 1,2 kg
(chegar nesse 1,2 kg que é o chato desse exercício, o certo seria ele te dar a densidade do esgoto pra você fazer esse cálculo, afinal, se eu tenho 30 ppm, ou é de kg pra kg, ou de m^3 pra m^3. Mas nesse exercício vc tem que considerar que quando vc relacionar os 30 ppm com o volume de esgoto, vc vai obter a massa de H2PO4, e não o volume... furada da banca)
A massa molar do H2PO4 é de 2 + 31 + 64 = 97 g/mol
(97 g)/(1 mol) = 1200g/x
x = 1200/97 = 12,37 mols (aproximadamente) de H2PO4.
Pra cada mol de H2PO4, eu vou ter 1 mol de Mg(NH4)PO4.6H2O, que possui massa molar de 24 + 14 + 4 + 31 + 64 + 12 + 96 = 245 g/mol.
Se teremos 12,37 mols de H2PO4, teremos também 12,37 mols de Mg(NH4)PO4.6H2O, o que terá uma massa de 12,37*245 = 3030,65 g
Mas o rendimento é de 90%, então teremos, na verdade, apenas 3030,65*0,9 = 2727,5 g.
Isso num só dia.
Pro mês inteiro, basta multiplicar por 30.
2727,5 g *30 = 81825 g = 81,82 kg.
Concentração = massa de solvente/volume de soluto
30*10^(-6) = m/(40000)
m = 1,2 kg
(chegar nesse 1,2 kg que é o chato desse exercício, o certo seria ele te dar a densidade do esgoto pra você fazer esse cálculo, afinal, se eu tenho 30 ppm, ou é de kg pra kg, ou de m^3 pra m^3. Mas nesse exercício vc tem que considerar que quando vc relacionar os 30 ppm com o volume de esgoto, vc vai obter a massa de H2PO4, e não o volume... furada da banca)
A massa molar do H2PO4 é de 2 + 31 + 64 = 97 g/mol
(97 g)/(1 mol) = 1200g/x
x = 1200/97 = 12,37 mols (aproximadamente) de H2PO4.
Pra cada mol de H2PO4, eu vou ter 1 mol de Mg(NH4)PO4.6H2O, que possui massa molar de 24 + 14 + 4 + 31 + 64 + 12 + 96 = 245 g/mol.
Se teremos 12,37 mols de H2PO4, teremos também 12,37 mols de Mg(NH4)PO4.6H2O, o que terá uma massa de 12,37*245 = 3030,65 g
Mas o rendimento é de 90%, então teremos, na verdade, apenas 3030,65*0,9 = 2727,5 g.
Isso num só dia.
Pro mês inteiro, basta multiplicar por 30.
2727,5 g *30 = 81825 g = 81,82 kg.

Matheus Bertolino- Fera

- Mensagens : 941
Data de inscrição : 10/08/2011
Idade : 28
Localização : Goioerê, Paraná, Brasil
 Re: Estequiometria
Re: Estequiometria
Ótima resolução Matheus! Muito obrigado!

Guilherme Mesquita- Jedi

- Mensagens : 301
Data de inscrição : 14/11/2012
Idade : 30
Localização : Santa Inês, Maranhão
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












