(FEI SP) pilhas
2 participantes
Página 1 de 1
 (FEI SP) pilhas
(FEI SP) pilhas
A vida de uma pilha, na qual as duas semirreações são 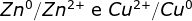 , pode ser aumentada, usando-se :
, pode ser aumentada, usando-se :
a) um eletrodo maior de zinco
b) um eletrodo maior de cobre
c) uma solução de sulfato de cobre (II) concentrada
d) uma solução de sulfato de zinco diluída.
e) uma ponte salina entre as soluções.
gabarito: estão corretas letras "a" e "c"
Por favor, explicar o porque de cada alternativa ser correta ou icorreta
a) um eletrodo maior de zinco
b) um eletrodo maior de cobre
c) uma solução de sulfato de cobre (II) concentrada
d) uma solução de sulfato de zinco diluída.
e) uma ponte salina entre as soluções.
gabarito: estão corretas letras "a" e "c"
Por favor, explicar o porque de cada alternativa ser correta ou icorreta
Leandro!- Mestre Jedi

- Mensagens : 963
Data de inscrição : 12/07/2011
Idade : 32
Localização : Rio de Janeiro - RJ
 Re: (FEI SP) pilhas
Re: (FEI SP) pilhas

Nessa pilha, o zinco se oxida (perde elétrons) e o cobre se reduz (ganha elétrons).
Portanto, a chapa de zinco (o eletrodo negativo) vai "emagrecendo" e a chapa de cobre (o eletrodo positivo) vai "engordando". Logo, quanto maior for o eletrodo de zinco, mais matéria e, portanto, mais elétrons tem pra utilizar. Já o eletrodo de cobre ser maior não vai fazer diferença.
Pela figura acima, a gente vê que há cátions cobre em solução. Esses cátions receberão elétrons e reduzir-se-ão (será que escrevi certo?? kkk). Se a solução estiver mais concentrada, haverá mais cátions em solução para "engordar" a chapa de cobre.
O fato de a solução de zinco estar diluída não vai prolongar a vida da pilha, porque o que interessa no eletrodo negativo é o tamanho da chapa de zinco.
A da ponte salina não sei dizer porque está errada. Eu sempre pensei que ela aumentava sim a vida útil da pilha.
Luís- Estrela Dourada

- Mensagens : 1177
Data de inscrição : 09/02/2011
 Re: (FEI SP) pilhas
Re: (FEI SP) pilhas
Obrigado, Luís.
Sua explicação foi bem clara.
E sobre a ponte salina...acredito que seja um fator essencial na pilha e não um fator de rendimento. A ponte de salina serve para gerar um circuito fechado, sem ela a corrente se moveria só para a meia-célula de cobre, concorda?
Sua explicação foi bem clara.
E sobre a ponte salina...acredito que seja um fator essencial na pilha e não um fator de rendimento. A ponte de salina serve para gerar um circuito fechado, sem ela a corrente se moveria só para a meia-célula de cobre, concorda?
Leandro!- Mestre Jedi

- Mensagens : 963
Data de inscrição : 12/07/2011
Idade : 32
Localização : Rio de Janeiro - RJ
 Re: (FEI SP) pilhas
Re: (FEI SP) pilhas
Pois é, Leandro! Obrigado por abrir meus olhos!
Parece que devemos ver a ponte salina como parte da estrutura da pilha, sendo que sem a ponte a pilha não funciona. Eu encontrei a seguinte explicação:
"Para evitar a mistura das soluções, utiliza-se a ponte salina, que une os dois compartimentos do eletrodo e completa, o circuito elétrico. A ponte salina é formada por um gel contendo solução salina aquosa concentrada dentro de um tubo. A solução salina mais utilizada é o KCl, pois os íons K+ e Cl– não afetam as reações que ocorrem nas células.
À medida que a lâmina de zinco corrói, a solução do eletrodo de zinco vai ganhando cátions (cargas positivas). Haverá no eletrodo excesso de cargas positivas.
À medida que a lâmina de cobre tem a sua massa aumentada, a solução do eletrodo de cobre vai perdendo cátions (cargas positivas). Haverá no eletrodo excesso de cargas negativas .
A função da ponte salina é manter o equilíbrio elétrico de cargas positivas e negativas nas soluções dos eletrodos. Assim, K+ migra da ponte para o eletrodo de cobre e Cl– migra para o eletrodo de zinco.
No condutor existe uma corrente de elétrons.
Na ponte salina existe uma corrente de íons."
Parece que devemos ver a ponte salina como parte da estrutura da pilha, sendo que sem a ponte a pilha não funciona. Eu encontrei a seguinte explicação:
"Para evitar a mistura das soluções, utiliza-se a ponte salina, que une os dois compartimentos do eletrodo e completa, o circuito elétrico. A ponte salina é formada por um gel contendo solução salina aquosa concentrada dentro de um tubo. A solução salina mais utilizada é o KCl, pois os íons K+ e Cl– não afetam as reações que ocorrem nas células.
À medida que a lâmina de zinco corrói, a solução do eletrodo de zinco vai ganhando cátions (cargas positivas). Haverá no eletrodo excesso de cargas positivas.
À medida que a lâmina de cobre tem a sua massa aumentada, a solução do eletrodo de cobre vai perdendo cátions (cargas positivas). Haverá no eletrodo excesso de cargas negativas .
A função da ponte salina é manter o equilíbrio elétrico de cargas positivas e negativas nas soluções dos eletrodos. Assim, K+ migra da ponte para o eletrodo de cobre e Cl– migra para o eletrodo de zinco.
No condutor existe uma corrente de elétrons.
Na ponte salina existe uma corrente de íons."
Luís- Estrela Dourada

- Mensagens : 1177
Data de inscrição : 09/02/2011
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












