Sobre Ligações Sigma e PI
4 participantes
PiR2 :: Química :: Química Orgânica
Página 1 de 1
 Sobre Ligações Sigma e PI
Sobre Ligações Sigma e PI
Prezados, possuo uma simples dúvida acerca das ligações Sigma e PI que creio eu, deva ser até mesmo redundante aos senhores, mas como sou uma pessoa que há muito tempo não revisa química naturalmente me surgiu ao voltar a estudar o conteúdo, pois bem, minha dúvida é: Ligações PI e Sigma ocorrem apenas entre carbono e elementos diferentes ou também entre outros elementos distintos? em uma cadeia orgânica se deve contar as ligações dos heteroátomos entre si?
Observe a figura abaixo:
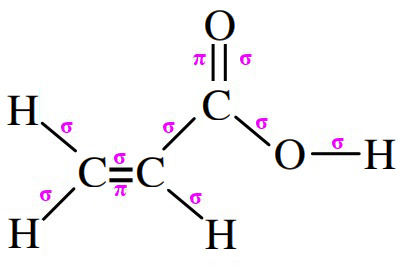
Percebe-se que o autor considerou como Sigma a ligação entre o oxigênio e o hidrogênio mais a direita da cadeia, , isto é correto? caso eu encontre esse tipo de situação em uma questão devo eu contar a ligação dos heteroátomos também?
, isto é correto? caso eu encontre esse tipo de situação em uma questão devo eu contar a ligação dos heteroátomos também?
Peço desculpas novamente se é algo redundante ou trivial, não é minha intenção poluir o fórum de modo algum, mas infelizmente não achei uma resposta satisfatória no google e ficar com esse tipo de dúvida muito básica me incomoda, obrigado aos que puderem se dispor a responder.
Observe a figura abaixo:

Percebe-se que o autor considerou como Sigma a ligação entre o oxigênio e o hidrogênio mais a direita da cadeia,
 , isto é correto? caso eu encontre esse tipo de situação em uma questão devo eu contar a ligação dos heteroátomos também?
, isto é correto? caso eu encontre esse tipo de situação em uma questão devo eu contar a ligação dos heteroátomos também?Peço desculpas novamente se é algo redundante ou trivial, não é minha intenção poluir o fórum de modo algum, mas infelizmente não achei uma resposta satisfatória no google e ficar com esse tipo de dúvida muito básica me incomoda, obrigado aos que puderem se dispor a responder.
Última edição por Booleano em Qui 14 Jul 2022, 09:42, editado 1 vez(es)

Booleano- Iniciante
- Mensagens : 5
Data de inscrição : 05/07/2022
 Re: Sobre Ligações Sigma e PI
Re: Sobre Ligações Sigma e PI
Uma ligação sigma é a sobreposição dos orbitais ligantes, enquanto que na ligação pi, é formada uma "ponte" entre os orbitais ligantes. Qualquer átomo que possa fazer uma ligação, fará uma ligação sigma, e o átomo que puder fazer duas ligações, fará uma sigma e uma pi, nessa ordem. Não sei bem o que quer dizer com contagem de ligação. Não se preocupe se sua dúvida é trivial ou não, o importante é aprender 
Booleano gosta desta mensagem
Booleano gosta desta mensagem
 Re: Sobre Ligações Sigma e PI
Re: Sobre Ligações Sigma e PI
Eu compreendo um pouco sua duvida, as vezes os autores pedem para contar quantas sigmas há e quantas pi há em determinada cadeia carbônica. Como amigo disse, o objetivo da ligação é estabilizar os átomos que dela participam, a primeira ligação é uma fusão dos orbitais s ( sigma) e a outra ocorre entre orbitais p que não se fundem e ficam apenas exercendo atração paralela ( se o átomo fazer uma dupla ligação ou tripla também terá pi independentemente se for carbono )
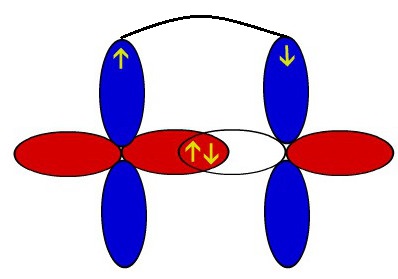
Se ele te pedir para contar as pi existentes em toda cadeia conte as que ocorrem em toda cadeia. Incluindo as do oxigênio, nitrogênio...
Agora se ele te pedir para julgar uma cadeia como Saturada ou insaturada, a ligação pi deve estar ocorrendo apenas entre carbonos. Não inportando se há ligações pi entre oxigeneo ou nitrogênio .

Se ele te pedir para contar as pi existentes em toda cadeia conte as que ocorrem em toda cadeia. Incluindo as do oxigênio, nitrogênio...
Agora se ele te pedir para julgar uma cadeia como Saturada ou insaturada, a ligação pi deve estar ocorrendo apenas entre carbonos. Não inportando se há ligações pi entre oxigeneo ou nitrogênio .

nathanvasoncelos958- Jedi

- Mensagens : 252
Data de inscrição : 30/04/2021
Idade : 23
Booleano e Vinittivs14 gostam desta mensagem
 Re: Sobre Ligações Sigma e PI
Re: Sobre Ligações Sigma e PI
Opa nem vi que respondeu '-' , Sorry amigo!!

nathanvasoncelos958- Jedi

- Mensagens : 252
Data de inscrição : 30/04/2021
Idade : 23
Booleano gosta desta mensagem
 Re: Sobre Ligações Sigma e PI
Re: Sobre Ligações Sigma e PI
Vinittivs14 escreveu:Uma ligação sigma é a sobreposição dos orbitais ligantes, enquanto que na ligação pi, é formada uma "ponte" entre os orbitais ligantes. Qualquer átomo que possa fazer uma ligação, fará uma ligação sigma, e o átomo que puder fazer duas ligações, fará uma sigma e uma pi.
nathanvasoncelos958 escreveu:O objetivo da ligação é estabilizar os átomos que dela participam, a primeira ligação é uma fusão dos orbitais s ( sigma) e a outra ocorre entre orbitais p que não se fundem e ficam apenas exercendo atração paralela ( se o átomo fazer uma dupla ligação ou tripla também terá pi independentemente se for carbono ).
Respostas excelentes senhores! eu tinha ficado na dúvida, pois normalmente as classificações são quase que sempre específicas o carbono, como você mesmo cita nathanvasoncelos958, considera-se apenas as pi entre carbonos para classificar uma cadeia como insaturada, mas aproveitando o tópico para não ter que criar outro, já que qualquer átomo que faz ligação pode fazer ligações pi e sigma, isso se restringe apenas as ligações covalentes?

Booleano- Iniciante
- Mensagens : 5
Data de inscrição : 05/07/2022
 Re: Sobre Ligações Sigma e PI
Re: Sobre Ligações Sigma e PI
É correto. Você, primeiro, precisa entender como funciona o processo de ligação covalente: para existir esse tipo de interação atômica, os elementos devem estabelecer uma relação de interpenetração de seus orbitais semipreenchidos. Usando o próprio exemplo que você trouxe entre o oxigênio e o hidrogênio, temos o seguinte:
Distribuição eletrônica do hidrogênio: 1s¹
Distribuição eletrônica do oxigênio: 1s² 2s² 2p⁴
Usando a representação clássica dos spins para cada elemento:
H: _↾ (s)
O: ⇃↾ (s) ⇃↾ (s) ⇃↾ (px) _↾ (py) _↾ (pz)
É daí que tiramos que o hidrogênio consegue estabelecer uma ligação, pois apresenta o subnível s desemparelhado, e o oxigênio dois, pois apresenta dois subníveis p desemparelhados.
O hidrogênio possui orbital s, que espacialmente se configura como uma região esférica. Este tipo de overlap (região em que a probabilidade de encontrar o par de elétrons compartilhada entre dois átomos é máxima) irá interagir frontalmente com o orbital atômico p (seja no eixo py, seja no eixo px). Adotando, por exemplo o eixo z, temos a seguinte representação espacial:

A interação frontal é sempre do tipo sigma (σ), podendo ser s-s, s-p ou p-p (existem outras interações, mas à nível de ensino médio, essas são as mais recorrentes). Na situação acima, temos σs-p (s do hidrogênio, p do oxigênio). A região oposta ao overlap, no eixo z, sofreu um "atrofiamento". Isso acontece porque a ligação covalente estabelecida exerce uma diferente região máxima de encontro dos elétrons, não mais nos seus orbitais, mas entre os seus átomos. Perceba, agora, que o oxigênio precisa estabelecer uma nova ligação covalente para garantir sua estabilidade. Esta será definida com o carbono. As justificativas serão as mesmas: o carbono, por meio da sua distribuição eletrônica, consegue estabelecer quatro ligações, pois seus subníveis apresentam quatro orbitais desemparelhados. A segunda interação atômica é sempre do tipo pi (π). Os outros colegas já contribuíram com a representação espacial dessa interação, releia a contribuição deles. Se existirem três ligações, a primeira será sigma, a segunda e a terceira, pi.
Essas representações só valem para ligações covalentes. Ligações iônicas não expressam esse tipo de interação.
Espero ter ajudado!
Distribuição eletrônica do hidrogênio: 1s¹
Distribuição eletrônica do oxigênio: 1s² 2s² 2p⁴
Usando a representação clássica dos spins para cada elemento:
H: _↾ (s)
O: ⇃↾ (s) ⇃↾ (s) ⇃↾ (px) _↾ (py) _↾ (pz)
É daí que tiramos que o hidrogênio consegue estabelecer uma ligação, pois apresenta o subnível s desemparelhado, e o oxigênio dois, pois apresenta dois subníveis p desemparelhados.
O hidrogênio possui orbital s, que espacialmente se configura como uma região esférica. Este tipo de overlap (região em que a probabilidade de encontrar o par de elétrons compartilhada entre dois átomos é máxima) irá interagir frontalmente com o orbital atômico p (seja no eixo py, seja no eixo px). Adotando, por exemplo o eixo z, temos a seguinte representação espacial:
A interação frontal é sempre do tipo sigma (σ), podendo ser s-s, s-p ou p-p (existem outras interações, mas à nível de ensino médio, essas são as mais recorrentes). Na situação acima, temos σs-p (s do hidrogênio, p do oxigênio). A região oposta ao overlap, no eixo z, sofreu um "atrofiamento". Isso acontece porque a ligação covalente estabelecida exerce uma diferente região máxima de encontro dos elétrons, não mais nos seus orbitais, mas entre os seus átomos. Perceba, agora, que o oxigênio precisa estabelecer uma nova ligação covalente para garantir sua estabilidade. Esta será definida com o carbono. As justificativas serão as mesmas: o carbono, por meio da sua distribuição eletrônica, consegue estabelecer quatro ligações, pois seus subníveis apresentam quatro orbitais desemparelhados. A segunda interação atômica é sempre do tipo pi (π). Os outros colegas já contribuíram com a representação espacial dessa interação, releia a contribuição deles. Se existirem três ligações, a primeira será sigma, a segunda e a terceira, pi.
Essas representações só valem para ligações covalentes. Ligações iônicas não expressam esse tipo de interação.
Espero ter ajudado!

qedpetrich- Monitor

- Mensagens : 2498
Data de inscrição : 05/07/2021
Idade : 24
Localização : Erechim - RS / Passo Fundo - RS
Ana Laura Guimarães, nathanvasoncelos958 e Booleano gostam desta mensagem
 Re: Sobre Ligações Sigma e PI
Re: Sobre Ligações Sigma e PI
qedpetrich escreveu:
Essas representações só valem para ligações covalentes. Ligações iônicas não expressam esse tipo de interação.
Espero ter ajudado!
Que aula! 🤯, muito obrigado pela paciência em sintetizar uma resposta tão completa!
Obrigado a todos vocês que puderam se dispor em me ajudar, fico bastante agradecido.

Booleano- Iniciante
- Mensagens : 5
Data de inscrição : 05/07/2022
nathanvasoncelos958 e qedpetrich gostam desta mensagem
 Tópicos semelhantes
Tópicos semelhantes» questao sobre ligações sigma e pi
» Ligações sigma
» Ligações Sigma e Pi
» UDESC ligações sigma e pi
» questão sobre ligações
» Ligações sigma
» Ligações Sigma e Pi
» UDESC ligações sigma e pi
» questão sobre ligações
PiR2 :: Química :: Química Orgânica
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos














