Solução Tampão
4 participantes
PiR2 :: Química :: Físico-Química
Página 1 de 1
 Solução Tampão
Solução Tampão
Por causa de soluções tampões, também chamadas de tamponantes, vacas dão mais leite e nós respiramos melhor. O tamponante representa uma categoria de compostos químicos. Um deles aparece no nosso corpo. É uma mistura derivada de gás carbônico e bicarbonato que facilita o fluxo de oxigênio no organismo. Assinale a alternativa em que o par de substâncias produz esta solução tampão.
a) NaHCO3; Na2CO3
b) H2CO3; Na2CO3
c) H2CO3, NaHCO3 --> correta ;
d) H2CO3; NaOH
Gostaria de uma explicação para essa questão...
a) NaHCO3; Na2CO3
b) H2CO3; Na2CO3
c) H2CO3, NaHCO3 --> correta ;
d) H2CO3; NaOH
Gostaria de uma explicação para essa questão...

zwelonu- Padawan

- Mensagens : 87
Data de inscrição : 13/08/2019
Idade : 22
Localização : Rio de Janeiro,RJ,Brasil
 Re: Solução Tampão
Re: Solução Tampão
Uma solução tampão é uma solução que sofre pequenas variações de pH ao se adicionar H+ ou OH-; há alguns tipos (ácida, básica...)
No geral, uma solução tamponada ácida é formada por um ácido fraco e a base conjugada (de bronsted-lowry: diferença de 1H+) desse ácido;
No geral, uma solução tamponada básica é formada uma base fraca e o ácido conjugado (diferença de 1H+) dessa base.
a) NaHCO3 --> sal básico; Na2CO3 --> sal básico --> errada
b) H2CO3 e Na2CO3 --> diferença de 2H+ --> não é a base conjugada
c) H2CO3 e Na+ + HCO3- --> diferença de 1H+ = base conjugada = correta
d) NaOH não eh a base conjugada do ácido carbônico pq nem eh um sal formado a partir dele
No geral, uma solução tamponada ácida é formada por um ácido fraco e a base conjugada (de bronsted-lowry: diferença de 1H+) desse ácido;
No geral, uma solução tamponada básica é formada uma base fraca e o ácido conjugado (diferença de 1H+) dessa base.
a) NaHCO3 --> sal básico; Na2CO3 --> sal básico --> errada
b) H2CO3 e Na2CO3 --> diferença de 2H+ --> não é a base conjugada
c) H2CO3 e Na+ + HCO3- --> diferença de 1H+ = base conjugada = correta
d) NaOH não eh a base conjugada do ácido carbônico pq nem eh um sal formado a partir dele

folettinhomed- Mestre Jedi

- Mensagens : 988
Data de inscrição : 23/02/2019
Idade : 24
Localização : Santa Cruz do Sul, RS, Brasil
 Re: Solução Tampão
Re: Solução Tampão
Uma solução tampão é formada por um ácido/base fraco com um sal inorgânico.
Nesse caso:
H2CO3 -> Ácido fraco
NaHCO3 -> Sal inorgânico
A principal função da solução tampão é resistir à variação de pH.
Isso vai ocorrer do seguinte modo:
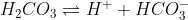
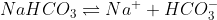
A seguinte solução vai resistir ao pH porque, quando os dois formarem os produtos, será deslocado o equilíbrio para a esquerda, diminuindo o H+. Desse modo, aumenta o pH.
Ou seja, o HCO3- do sal vai deslocar o equilíbrio do ácido para a esquerda.
Nesse caso:
H2CO3 -> Ácido fraco
NaHCO3 -> Sal inorgânico
A principal função da solução tampão é resistir à variação de pH.
Isso vai ocorrer do seguinte modo:
A seguinte solução vai resistir ao pH porque, quando os dois formarem os produtos, será deslocado o equilíbrio para a esquerda, diminuindo o H+. Desse modo, aumenta o pH.
Ou seja, o HCO3- do sal vai deslocar o equilíbrio do ácido para a esquerda.

Dr.Astro- Mestre Jedi

- Mensagens : 516
Data de inscrição : 12/06/2019
Localização : Brasil
 Re: Solução Tampão
Re: Solução Tampão
Olá, folettinhomed. Pode me explicar melhor essa questão da conjugação?folettinhomed escreveu:Uma solução tampão é uma solução que sofre pequenas variações de pH ao se adicionar H+ ou OH-; há alguns tipos (ácida, básica...)
No geral, uma solução tamponada ácida é formada por um ácido fraco e a base conjugada (de bronsted-lowry: diferença de 1H+) desse ácido;
No geral, uma solução tamponada básica é formada uma base fraca e o ácido conjugado (diferença de 1H+) dessa base.
a) NaHCO3 --> sal básico; Na2CO3 --> sal básico --> errada
b) H2CO3 e Na2CO3 --> diferença de 2H+ --> não é a base conjugada
c) H2CO3 e Na+ + HCO3- --> diferença de 1H+ = base conjugada = correta
d) NaOH não eh a base conjugada do ácido carbônico pq nem eh um sal formado a partir dele

Dr.Astro- Mestre Jedi

- Mensagens : 516
Data de inscrição : 12/06/2019
Localização : Brasil
 Re: Solução Tampão
Re: Solução Tampão
Bicarbonato só poderia ser NaHCO3.
a) NaHCO3; Na2CO3
b) H2CO3; Na2CO3
c) H2CO3, NaHCO3
d) H2CO3; NaOH
Se eu produzo bicarbonato e gás carbonico na(a) fico com
NaHCO3 + CO2 + molécula diferente da água
Agora, na (c), fico com
NaHCO3 + CO2 + H20
Como quero que o pH do meio não se altere e o CO2 adquira propriedades ácidas, é a alternativa correta
a) NaHCO3; Na2CO3
b) H2CO3; Na2CO3
c) H2CO3, NaHCO3
d) H2CO3; NaOH
Se eu produzo bicarbonato e gás carbonico na(a) fico com
NaHCO3 + CO2 + molécula diferente da água
Agora, na (c), fico com
NaHCO3 + CO2 + H20
Como quero que o pH do meio não se altere e o CO2 adquira propriedades ácidas, é a alternativa correta
Nickds12- Mestre Jedi

- Mensagens : 577
Data de inscrição : 31/08/2019
Idade : 27
Localização : RJ
 Re: Solução Tampão
Re: Solução Tampão
Base de bronsted-lowry= recebe H+Dr.Astro escreveu:
Olá, folettinhomed. Pode me explicar melhor essa questão da conjugação?
Ácido de bronsted-lowry= doa H+
Ex:solução tampão ácido
ácido fraco ->>> ioniza pouco em H2O
H3C-COOH(aq) + H2O(l)----> H3O+(aq) + H3C-COO-(aq)
sal solúvel ->>> libera a base conjugada do ácido 100%
H3C-COONa(aq) ----> Na+(aq) + H3C-COO-(aq)
Em vermelho + azul está formado o par ácido-base de bronsted-lowry, e eh ele quem provocará a estabilidade do ssistema.
Adicione H+: Base conjugada do ácido reagirá com ele, formando o ácido, que eh fraco, então diminui bem pouco o pH
Adicione OH-: Ácido fraco pouco ionizado(em grande concentração) reagirá com ela, formando a base conjugada e H2O= aumenta pouco o pH
Portanto, tu podes analisar quem forma o sistema tampão procurando o ácido/base fraca e quem eh a base/ácido conjugado, pois são eles quem garantem a estabilidade, ou seja, procura quem tem diferença de H+ e vem do mesmo composto
Avisa se n entender, nao eh um conceito mt dificil, mas só digitando eh complicado de explicar
Última edição por folettinhomed em 2/10/2019, 3:53 pm, editado 1 vez(es)

folettinhomed- Mestre Jedi

- Mensagens : 988
Data de inscrição : 23/02/2019
Idade : 24
Localização : Santa Cruz do Sul, RS, Brasil
 Re: Solução Tampão
Re: Solução Tampão
Na verdade, o pH altera, mas muito pouco. Desculpa a correção, mas eh q ja vi provas boas cobrando exatamente issoNickds12 escreveu:Bicarbonato só poderia ser NaHCO3.
a) NaHCO3; Na2CO3
[size=30] b)[/size] H2CO3; Na2CO3
[size=30] c)[/size] H2CO3, NaHCO3
[size=30]d) [/size]H2CO3; NaOH
Se eu produzo bicarbonato e gás carbonico na(a) fico com
NaHCO3 + CO2 + molécula diferente da água
Agora, na (c), fico com
NaHCO3 + CO2 + H20
Como quero que o pH do meio não se altere e o CO2 adquira propriedades ácidas, é a alternativa correta

folettinhomed- Mestre Jedi

- Mensagens : 988
Data de inscrição : 23/02/2019
Idade : 24
Localização : Santa Cruz do Sul, RS, Brasil
PiR2 :: Química :: Físico-Química
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












