Hibridação do NO3-
Página 1 de 1
 Hibridação do NO3-
Hibridação do NO3-
Não estou conseguindo chegar na forma hibridada do NO3- para organizar o diagrama de energia 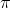 do íon.
do íon.
A sua forma estrutural contém hibrido de ressonância, correto, e sua geometria é trigonal plana, hibridação sp2. Porém, não consigo representar.
N = 5 e- valência = [ || ] [ | | | ], ou seja, 3 elétrons desemparelhados. No caso, se a hibridação é sp2 o resultado seria [ || | | ] [ | ], correto? Há nenhum par isolado no N nesta representação mas, por Lewis, não. Como o N formaria 3 ligações sigma e uma pi? O que estou confundindo?
A sua forma estrutural contém hibrido de ressonância, correto, e sua geometria é trigonal plana, hibridação sp2. Porém, não consigo representar.
N = 5 e- valência = [ || ] [ | | | ], ou seja, 3 elétrons desemparelhados. No caso, se a hibridação é sp2 o resultado seria [ || | | ] [ | ], correto? Há nenhum par isolado no N nesta representação mas, por Lewis, não. Como o N formaria 3 ligações sigma e uma pi? O que estou confundindo?
Kaminii- Recebeu o sabre de luz

- Mensagens : 151
Data de inscrição : 26/08/2017
Idade : 24
Localização : Divinópolis Minas Gerais Brasil
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












