Ionização
2 participantes
Página 1 de 1
 Ionização
Ionização
O gráfico abaixo mostra a variação da primeira energia de ionização em função do número atômico do elemento.
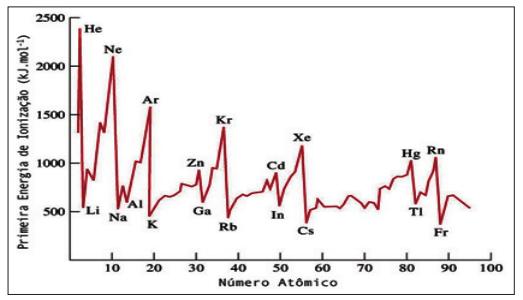
De acordo com o gráfico:
(A) Sempre que aumenta o número atômico, diminui a energia de ionização.
(B) Comparando elementos do mesmo período, os gases nobres têm a 1a energia de ionização menor que a dos metais alcalinos.
(C) Não há relação entre o raio atômico e a energia de ionização.
(D) Quanto mais camadas eletrônicas um gás nobre tem, mais fácil é para se retirar o 1o elétron.
(E) O gráfico expressa os valores de energia para se retirar 1 único elétron de um 1 único átomo.
Por que não é a (E)??
E na (D), não deveria ser o último elétron, ao invés do primeiro?? O primeiro é o mais próximo do núcleo positivo e, portanto, tem mais atração, sendo o mais difícil. Seria mais fácil retirar o último elétron com mais camadas, por que aí ficaria mais distante da força de atração do núcleo...

De acordo com o gráfico:
(A) Sempre que aumenta o número atômico, diminui a energia de ionização.
(B) Comparando elementos do mesmo período, os gases nobres têm a 1a energia de ionização menor que a dos metais alcalinos.
(C) Não há relação entre o raio atômico e a energia de ionização.
(D) Quanto mais camadas eletrônicas um gás nobre tem, mais fácil é para se retirar o 1o elétron.
(E) O gráfico expressa os valores de energia para se retirar 1 único elétron de um 1 único átomo.
Por que não é a (E)??
E na (D), não deveria ser o último elétron, ao invés do primeiro?? O primeiro é o mais próximo do núcleo positivo e, portanto, tem mais atração, sendo o mais difícil. Seria mais fácil retirar o último elétron com mais camadas, por que aí ficaria mais distante da força de atração do núcleo...
Liliana Rodrigues- Estrela Dourada

- Mensagens : 2082
Data de inscrição : 16/03/2016
Idade : 27
Localização : Ribeirão Preto - SP
 Re: Ionização
Re: Ionização
Maior número de camadas, maior afastamento do último elétron até o núcleo. Consequentemente, é menor a energia de ionização.
Um exemplo palpável disso é pela propriedade. Sabe-se que é maior da esquerda para direita e de cima para baixo. Ou seja, quanto menor o tamanho do átomo, da sua camada, maior energia de ionização.
Um exemplo palpável disso é pela propriedade. Sabe-se que é maior da esquerda para direita e de cima para baixo. Ou seja, quanto menor o tamanho do átomo, da sua camada, maior energia de ionização.

MalcolnMed- Mestre Jedi

- Mensagens : 705
Data de inscrição : 03/04/2017
Idade : 26
Localização : São Paulo
 Re: Ionização
Re: Ionização
MalcolnMed escreveu:Maior número de camadas, maior afastamento do último elétron até o núcleo. Consequentemente, é menor a energia de ionização.
Concordo com você, mas eu quis dizer que, então, deveria ser "mais fácil é para se retirar o último elétron", e não o 1º, por que o primeiro é que está mais perto do núcleo positivo, e por isso a força de atração é maior.
E qual o erro da (E)? Não consigo encontrar...
Liliana Rodrigues- Estrela Dourada

- Mensagens : 2082
Data de inscrição : 16/03/2016
Idade : 27
Localização : Ribeirão Preto - SP
 Re: Ionização
Re: Ionização
Dizemos primeiro elétron porque;
energia de ionização do 1º elétron retirado < 2º retirado < 3º retirado < n retirados..
O "primeiro" elétron, portanto, se refere ao primeiro retirado.
O erro da E é porque tem muitos átomos ai, não só um xD
energia de ionização do 1º elétron retirado < 2º retirado < 3º retirado < n retirados..
O "primeiro" elétron, portanto, se refere ao primeiro retirado.
O erro da E é porque tem muitos átomos ai, não só um xD

MalcolnMed- Mestre Jedi

- Mensagens : 705
Data de inscrição : 03/04/2017
Idade : 26
Localização : São Paulo
 Re: Ionização
Re: Ionização
MalcolnMed escreveu:O erro da E é porque tem muitos átomos ai, não só um xD
Eu pensei nisso a princípio, mas como a alternativa fala "O gráfico expressa os valores de energia", eu pensei que estava se referindo aos valores de todos os átomos.
E eu também tinha pensado que o 1º elétron era o mais próximo do núcleo por causa das camadas K,L,M,N....
Liliana Rodrigues- Estrela Dourada

- Mensagens : 2082
Data de inscrição : 16/03/2016
Idade : 27
Localização : Ribeirão Preto - SP
 Tópicos semelhantes
Tópicos semelhantes» En. de ionização ou potencial de ionização, definição
» En. de ionização ou potencial de ionização, definição
» ionização
» Ionização
» Ionização
» En. de ionização ou potencial de ionização, definição
» ionização
» Ionização
» Ionização
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












