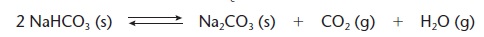Equilíbrio Heterogêneo
2 participantes
PiR2 :: Química :: Físico-Química
Página 1 de 1

Royals- Jedi

- Mensagens : 303
Data de inscrição : 05/03/2016
Idade : 27
Localização : Morro Agudo SP Brazil
 Re: Equilíbrio Heterogêneo
Re: Equilíbrio Heterogêneo
Boa noite!
Nesse tipo de questão que envolve KC e KP, saber a relação dos dois é muito útil: KP = KC x (RT)^-∆n
∆N é: (a+b) - (c+d), em que essas letras são os coeficientes estequiométricos de cada membro (aquilo que você põe como expoente na expressão do KC). No segundo parênteses entram os coeficientes do produto, no primeiro os do reagente.
Primeiro, vamos calcular o ∆n: (0) - ( 0 + 1 + 1) => -2
Atente-se ao fato de que, na fórmula, é -∆n; portanto -(-2) => +2
Agora que temos o ∆n, vamos manipular aquela fórmula um pouco para atender as exigências da questão:
KP = KC x (RT)^-∆n
KP/KC = (RT)^2
Pronto. Sua resposta.
Se você souber manipular um cadinho essa fórmula, verá que é possível isolar tanto o KP quanto o KC, o que acarretará apenas na mudança do sinal do expoente(do -∆n).
Nesse tipo de questão que envolve KC e KP, saber a relação dos dois é muito útil: KP = KC x (RT)^-∆n
∆N é: (a+b) - (c+d), em que essas letras são os coeficientes estequiométricos de cada membro (aquilo que você põe como expoente na expressão do KC). No segundo parênteses entram os coeficientes do produto, no primeiro os do reagente.
Primeiro, vamos calcular o ∆n: (0) - ( 0 + 1 + 1) => -2
Atente-se ao fato de que, na fórmula, é -∆n; portanto -(-2) => +2
Agora que temos o ∆n, vamos manipular aquela fórmula um pouco para atender as exigências da questão:
KP = KC x (RT)^-∆n
KP/KC = (RT)^2
Pronto. Sua resposta.
Se você souber manipular um cadinho essa fórmula, verá que é possível isolar tanto o KP quanto o KC, o que acarretará apenas na mudança do sinal do expoente(do -∆n).

Dr.Gregory House- Recebeu o sabre de luz

- Mensagens : 136
Data de inscrição : 16/04/2017
Idade : 25
Localização : Rio de Janeiro, Rio de Janeiro, Brasil
 Re: Equilíbrio Heterogêneo
Re: Equilíbrio Heterogêneo
Nossa, é verdade, com essa relação eu teria matado o exercício. Porém, eu não me lembrava dela.Dr.Gregory House escreveu:Boa noite!
Nesse tipo de questão que envolve KC e KP, saber a relação dos dois é muito útil: KP = KC x (RT)^-∆n
∆N é: (a+b) - (c+d), em que essas letras são os coeficientes estequiométricos de cada membro (aquilo que você põe como expoente na expressão do KC). No segundo parênteses entram os coeficientes do produto, no primeiro os do reagente.
Primeiro, vamos calcular o ∆n: (0) - ( 0 + 1 + 1) => -2
Atente-se ao fato de que, na fórmula, é -∆n; portanto -(-2) => +2
Agora que temos o ∆n, vamos manipular aquela fórmula um pouco para atender as exigências da questão:
KP = KC x (RT)^-∆n
KP/KC = (RT)^2
Pronto. Sua resposta.
Se você souber manipular um cadinho essa fórmula, verá que é possível isolar tanto o KP quanto o KC, o que acarretará apenas na mudança do sinal do expoente(do -∆n).
Vou começar a anotar as fórmulas no bloco de notas para não me esquecer de nenhuma! Valeu, cara.

Royals- Jedi

- Mensagens : 303
Data de inscrição : 05/03/2016
Idade : 27
Localização : Morro Agudo SP Brazil
 Tópicos semelhantes
Tópicos semelhantes» Equilíbrio Iônico x Equilíbrio Heterogêneo
» Equilíbrio heterogêneo III
» Equilíbrio Heterogêneo
» Equilíbrio Heterogêneo
» Equilíbrio heterogêneo
» Equilíbrio heterogêneo III
» Equilíbrio Heterogêneo
» Equilíbrio Heterogêneo
» Equilíbrio heterogêneo
PiR2 :: Química :: Físico-Química
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos