isotopos naturais
4 participantes
Página 1 de 1
 isotopos naturais
isotopos naturais
O gálio constitui-se de dois isótopos naturais com massas de 68,926 e 70,925 u.
(a) Quantos prótons e quantos nêutrons existem no núcleo de cada isótopo?
(b) A massa atômica média do gálio é 69,72 u. Calcule a abundância de cada isótopo
isso e outra duvida eu consegui fazer mas nao sei se esta certo
(a) Quantos prótons e quantos nêutrons existem no núcleo de cada isótopo?
(b) A massa atômica média do gálio é 69,72 u. Calcule a abundância de cada isótopo
isso e outra duvida eu consegui fazer mas nao sei se esta certo
fnoronhars- Iniciante
- Mensagens : 15
Data de inscrição : 08/04/2011
Idade : 54
Localização : sao leopoldo rs brasil
 Re: isotopos naturais
Re: isotopos naturais
A letra a) não consegui de certeza, mas a b) eu fiz:
+(M_2 \times Porcentagem_2)}{100})
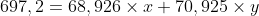
E temos que
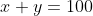
Resolva este sistema e pronto
E temos que
Resolva este sistema e pronto

JoaoGabriel- Monitor

- Mensagens : 2344
Data de inscrição : 30/09/2010
Idade : 29
Localização : Rio de Janeiro
 Re: isotopos naturais
Re: isotopos naturais
A massa atômica de um elemento será dada pela média ponderada das massas atômicas dos seus isótopos.
Perceba que a soma das ocorrências dos isótopos devem ser 100%.
Portanto, se ele tiver 2 isótopos x e y, ficará x + y = 100
Se ele tiver 3 isótopos x, y e z, ficará x + y + z = 100
E assim sucessivamente.
Assim, você poderá sempre montar um sistema linear.
Perceba que a soma das ocorrências dos isótopos devem ser 100%.
Portanto, se ele tiver 2 isótopos x e y, ficará x + y = 100
Se ele tiver 3 isótopos x, y e z, ficará x + y + z = 100
E assim sucessivamente.
Assim, você poderá sempre montar um sistema linear.

Matheus Basílio- Elite Jedi

- Mensagens : 344
Data de inscrição : 22/10/2010
Idade : 28
Localização : Palmas, Tocantins
 Re: isotopos naturais
Re: isotopos naturais
Já tava me esquecendo,
Na letra "a", basta utilizar as velhas e conhecidas fórmulas:
nº de prótons = nº de elétrons = número atômico (para sistemas com carga elétrica nula, os não-íons)
número de massa = número de prótons + número de nêutrons
Na letra "b" é isso ai que o João Gabriel disse.
Na letra "a", basta utilizar as velhas e conhecidas fórmulas:
nº de prótons = nº de elétrons = número atômico (para sistemas com carga elétrica nula, os não-íons)
número de massa = número de prótons + número de nêutrons
Na letra "b" é isso ai que o João Gabriel disse.

Matheus Basílio- Elite Jedi

- Mensagens : 344
Data de inscrição : 22/10/2010
Idade : 28
Localização : Palmas, Tocantins
 Re: isotopos naturais
Re: isotopos naturais
Matheus Basílio como ficaria a resolução final da letra "a" ?

Adam Zunoeta- Monitor

- Mensagens : 4223
Data de inscrição : 25/08/2010
Idade : 35
Localização : Cuiabá
 Re: isotopos naturais
Re: isotopos naturais
Daqui a pouco respondo, vou almoçar, e já volto

Matheus Basílio- Elite Jedi

- Mensagens : 344
Data de inscrição : 22/10/2010
Idade : 28
Localização : Palmas, Tocantins
 Re: isotopos naturais
Re: isotopos naturais
Consultando na Tabela Periódica, o Gálio tem número atômico 31.
Pro primeiro isótopo:
p = z -> p = 31
A = p + n
n = 68,926 - 31 = 37,926
Pro segundo:
p = z -> p = 31
A = p + n
n = 70,925 - 31 = 39,925
Acho que é isso ai!
Pro primeiro isótopo:
p = z -> p = 31
A = p + n
n = 68,926 - 31 = 37,926
Pro segundo:
p = z -> p = 31
A = p + n
n = 70,925 - 31 = 39,925
Acho que é isso ai!

Matheus Basílio- Elite Jedi

- Mensagens : 344
Data de inscrição : 22/10/2010
Idade : 28
Localização : Palmas, Tocantins
 Re: isotopos naturais
Re: isotopos naturais
Se quiserem que eu responda a "b", é só pedir!

Matheus Basílio- Elite Jedi

- Mensagens : 344
Data de inscrição : 22/10/2010
Idade : 28
Localização : Palmas, Tocantins
 Re: isotopos naturais
Re: isotopos naturais
Matheus Basílio, show não tinha sacado em fixar o p.
Vlw

Vlw

Adam Zunoeta- Monitor

- Mensagens : 4223
Data de inscrição : 25/08/2010
Idade : 35
Localização : Cuiabá
 Re: isotopos naturais
Re: isotopos naturais
O que acontece é que o número atômico é o que caracteriza cada elemento químico. Sendo assim, não existem átomos de elementos químicos diferentes com o mesmo número atômico. Se têm o mesmo número atômico são o mesmo elemento.

Matheus Basílio- Elite Jedi

- Mensagens : 344
Data de inscrição : 22/10/2010
Idade : 28
Localização : Palmas, Tocantins
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












