Soluções
2 participantes
Página 1 de 1
 Soluções
Soluções
25 mL de CaCl2 0,15 mol/L e 35 mL de AgNO3 0,12 mol/L são misturados.
a) Quantos gramas de AgCl são precipitados?
b) Quais são as concentrações dos íons de Ca²,Cl,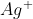 Ag e NO3 que permanecem na solução.
Ag e NO3 que permanecem na solução.
Se puder deixar o esboço de como fazer eu agradeceria, se souber por favor responda, obrigado.
a) Quantos gramas de AgCl são precipitados?
b) Quais são as concentrações dos íons de Ca²,Cl,
Se puder deixar o esboço de como fazer eu agradeceria, se souber por favor responda, obrigado.
Última edição por Tr1kZ em Qua 17 Out 2012, 06:57, editado 2 vez(es)

Tr1kZ- Padawan

- Mensagens : 85
Data de inscrição : 19/05/2011
Idade : 30
Localização : Divinópolis, MG, Brazil
 Re: Soluções
Re: Soluções
a) CaCl2 + 2AgNO3 ----> 2AgCl + Ca(NO3)2
1000 mL (CaCl2) ---- 0,15 mol
25 mL (CaCl2) ---- X mol
X = 0,00375 mol (CaCl2)
1000 mL (AgNO3) ---- 0,12 mol (AgNO3)
35 mL (AgNO3) ---- Y
Y = 0,0042 mol (AgNO3)
* Repare que CaCl2 está em excesso
* 2 mol de AgNO3 originam 2 mol de AgCl, com isso 0,0042 mol de AgNO3 originam 0,0042 mol de AgCl
1 mol (AgCl) ---- 143,5g (AgCl)
0,0042 mol (AgCl) ---- Z
Z = 0,6027g de AgCl precipitado
b)
0,00375 mol (CaCl2) ---- 60 mL
X mol (CaCl2) ---- 1000 mL
X = 0,0625 mol/L de Ca{2+}
0,0042 mol (AgNO3) ---- 60 mL
Y (AgNO3) ---- 1000 mL
Y = 0,07 mol/L de NO3 {1-}
1 mol (CaCl2) --- 2 mols (AgNO3)
Z ---- 0,0042 mol (AgNO3)
Z = 0,0024 mol (CaCl2)
0,00375 mol - 0,0024 mol = 0,00135 mol em excesso de CaCl2
com isso tem-se 2 . 0,00135 mol de Cl em excesso ==> 0,0027 mol deCl em excesso.
0,0027 mol --- 60 mL
C --- 1000 mL
C = 0,045 mol / L de Cl {-1}
* Acho que td o Ag {+1} foi precipitado.
1000 mL (CaCl2) ---- 0,15 mol
25 mL (CaCl2) ---- X mol
X = 0,00375 mol (CaCl2)
1000 mL (AgNO3) ---- 0,12 mol (AgNO3)
35 mL (AgNO3) ---- Y
Y = 0,0042 mol (AgNO3)
* Repare que CaCl2 está em excesso
* 2 mol de AgNO3 originam 2 mol de AgCl, com isso 0,0042 mol de AgNO3 originam 0,0042 mol de AgCl
1 mol (AgCl) ---- 143,5g (AgCl)
0,0042 mol (AgCl) ---- Z
Z = 0,6027g de AgCl precipitado
b)
0,00375 mol (CaCl2) ---- 60 mL
X mol (CaCl2) ---- 1000 mL
X = 0,0625 mol/L de Ca{2+}
0,0042 mol (AgNO3) ---- 60 mL
Y (AgNO3) ---- 1000 mL
Y = 0,07 mol/L de NO3 {1-}
1 mol (CaCl2) --- 2 mols (AgNO3)
Z ---- 0,0042 mol (AgNO3)
Z = 0,0024 mol (CaCl2)
0,00375 mol - 0,0024 mol = 0,00135 mol em excesso de CaCl2
com isso tem-se 2 . 0,00135 mol de Cl em excesso ==> 0,0027 mol deCl em excesso.
0,0027 mol --- 60 mL
C --- 1000 mL
C = 0,045 mol / L de Cl {-1}
* Acho que td o Ag {+1} foi precipitado.
jpdf01- Iniciante
- Mensagens : 15
Data de inscrição : 10/06/2012
Idade : 30
Localização : Juiz de Fora, MG, Brasil
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|













