titulação e ponto de equivalência
3 participantes
Página 1 de 1
 titulação e ponto de equivalência
titulação e ponto de equivalência
Considere as afirmações abaixo relativas à concentração (mol/L) das espécies químicas presentes no ponto de equivalência da titulação de um ácido forte (do tipo HA) com uma base forte (do tipo BOH):
I. a concentração do ânion é igual à concentração do cátion
é igual à concentração do cátion 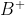
II. a concentração do cátion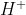 é igual à constante de dissociação do ácido HA
é igual à constante de dissociação do ácido HA
III.a concentração do cátion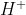 consumido é igual à concentração inicial do ácido HA
consumido é igual à concentração inicial do ácido HA
IV. A concentração do cátion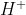 é igual à concentração do ânion
é igual à concentração do ânion 
V. a concentração do cátion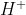 é igual a concentração do cátion
é igual a concentração do cátion 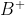
Das afirmações, quais estão corretas?
gabarito: I e III
Demonstrar,por favor, porque é falsa ou verdadeira cada afirmação.
I. a concentração do ânion
II. a concentração do cátion
III.a concentração do cátion
IV. A concentração do cátion
V. a concentração do cátion
Das afirmações, quais estão corretas?
gabarito: I e III
Demonstrar,por favor, porque é falsa ou verdadeira cada afirmação.
Leandro!- Mestre Jedi

- Mensagens : 963
Data de inscrição : 12/07/2011
Idade : 32
Localização : Rio de Janeiro - RJ
 Re: titulação e ponto de equivalência
Re: titulação e ponto de equivalência
Olá Leandro
Sei que já faz tempo a mensagem mas dê uma olhada nessa resolução aqui, acredito que dê para entender:
As soluções de um ácido forte e da base forte estão, respectivamente, totalmente ionizada e dissociada:
HA(aq) ---100%---> H+(aq) + A-(aq)
Então temos, [HA]inicial = [H+] (afirmação III é correta)
BOH(s) ---100%---> B+(aq) + OH-(aq)
No ponto de equivalência da titulação, temos a neutralização estequiométrica :
H+ + OH- ---> H2O
e a presença dos íons espectadores B+ e A- , cujas concentrações molares são iguais (afirmação I é correta).
A constante de ionização é expressa por:
![Ka = \frac{[H^{+}]\cdot [A^{-}]}{[HA]}](http://latex.codecogs.com/gif.latex?Ka = \frac{[H^{+}]\cdot [A^{-}]}{[HA]})
e, no caso de um ácido forte,seu valor numérico é muito grande. No ponto de equivalência, a [H+] presente é devida à auto-ionização da água:
[H+]equiv. = 10-7 mol/L
Logo![Ka \neq [H^+]equiv.](http://latex.codecogs.com/gif.latex?Ka \neq [H^+]equiv.) , (afirmação II é errada).
, (afirmação II é errada).
No ponto de equivalência temos:
[H+]equiv. = 10-7 mol/L. Como [B+] = [A-] e não necessariamente iguais a 10-7 mol/L, concluímos que as afirmações IV e V são erradas.
Fonte:
http://pt.scribd.com/doc/104351975/ita2001q
Para ajudar um pouco mais, o ponto de equivalência de uma titulação ácido forte e base forte é caracterizado pela neutralização total, ou seja, o número de mols de base adicionados é igual ao número de mols de ácido na solução.
Como ambos são fortes e se dissocia (base) e ioniza (ácido) completamente podemos dizer que a concentração do cátion da base é igual à concentração do ânion do ácido (sal).
Além disso todo o H+ proveniente do ácido reage com todo o OH- da base, como já disse, o que faz com que o H+ e OH- presentes sejam apenas da auto-ionização da água e o pH = 7 (neutro).
H+ + OH- ---> H2O ............. kw = [H+].[OH-] = 1,0 x 10-14
[H+] = [OH-] = 1,0 x 10-7
pH = pOH = 7
Espero que isso ajude =)
Sei que já faz tempo a mensagem mas dê uma olhada nessa resolução aqui, acredito que dê para entender:
As soluções de um ácido forte e da base forte estão, respectivamente, totalmente ionizada e dissociada:
HA(aq) ---100%---> H+(aq) + A-(aq)
Então temos, [HA]inicial = [H+] (afirmação III é correta)
BOH(s) ---100%---> B+(aq) + OH-(aq)
No ponto de equivalência da titulação, temos a neutralização estequiométrica :
H+ + OH- ---> H2O
e a presença dos íons espectadores B+ e A- , cujas concentrações molares são iguais (afirmação I é correta).
A constante de ionização é expressa por:
e, no caso de um ácido forte,seu valor numérico é muito grande. No ponto de equivalência, a [H+] presente é devida à auto-ionização da água:
[H+]equiv. = 10-7 mol/L
Logo
No ponto de equivalência temos:
[H+]equiv. = 10-7 mol/L. Como [B+] = [A-] e não necessariamente iguais a 10-7 mol/L, concluímos que as afirmações IV e V são erradas.
Fonte:
http://pt.scribd.com/doc/104351975/ita2001q
Para ajudar um pouco mais, o ponto de equivalência de uma titulação ácido forte e base forte é caracterizado pela neutralização total, ou seja, o número de mols de base adicionados é igual ao número de mols de ácido na solução.
Como ambos são fortes e se dissocia (base) e ioniza (ácido) completamente podemos dizer que a concentração do cátion da base é igual à concentração do ânion do ácido (sal).
Além disso todo o H+ proveniente do ácido reage com todo o OH- da base, como já disse, o que faz com que o H+ e OH- presentes sejam apenas da auto-ionização da água e o pH = 7 (neutro).
H+ + OH- ---> H2O ............. kw = [H+].[OH-] = 1,0 x 10-14
[H+] = [OH-] = 1,0 x 10-7
pH = pOH = 7
Espero que isso ajude =)

Hillyno_o- Iniciante
- Mensagens : 41
Data de inscrição : 15/06/2012
Localização : Rio de Janeiro
 Re: titulação e ponto de equivalência
Re: titulação e ponto de equivalência
CavaloHillyno_o escreveu:Olá Leandro
Sei que já faz tempo a mensagem mas dê uma olhada nessa resolução aqui, acredito que dê para entender:
As soluções de um ácido forte e da base forte estão, respectivamente, totalmente ionizada e dissociada:
HA(aq) ---100%---> H+(aq) + A-(aq)
Então temos, [HA]inicial = [H+] (afirmação III é correta)
BOH(s) ---100%---> B+(aq) + OH-(aq)
No ponto de equivalência da titulação, temos a neutralização estequiométrica :
H+ + OH- ---> H2O
e a presença dos íons espectadores B+ e A- , cujas concentrações molares são iguais (afirmação I é correta).
A constante de ionização é expressa por:
e, no caso de um ácido forte,seu valor numérico é muito grande. No ponto de equivalência, a [H+] presente é devida à auto-ionização da água:
[H+]equiv. = 10-7 mol/L
Logo, (afirmação II é errada).
No ponto de equivalência temos:
[H+]equiv. = 10-7 mol/L. Como [B+] = [A-] e não necessariamente iguais a 10-7 mol/L, concluímos que as afirmações IV e V são erradas.
Fonte:
http://pt.scribd.com/doc/104351975/ita2001q
Para ajudar um pouco mais, o ponto de equivalência de uma titulação ácido forte e base forte é caracterizado pela neutralização total, ou seja, o número de mols de base adicionados é igual ao número de mols de ácido na solução.
Como ambos são fortes e se dissocia (base) e ioniza (ácido) completamente podemos dizer que a concentração do cátion da base é igual à concentração do ânion do ácido (sal).
Além disso todo o H+ proveniente do ácido reage com todo o OH- da base, como já disse, o que faz com que o H+ e OH- presentes sejam apenas da auto-ionização da água e o pH = 7 (neutro).
H+ + OH- ---> H2O ............. kw = [H+].[OH-] = 1,0 x 10-14
[H+] = [OH-] = 1,0 x 10-7
pH = pOH = 7
Espero que isso ajude =)

Royals- Jedi

- Mensagens : 303
Data de inscrição : 05/03/2016
Idade : 27
Localização : Morro Agudo SP Brazil
 Tópicos semelhantes
Tópicos semelhantes» Distância entre plano e ponto, reta e ponto
» Distância de ponto a reta, de ponto ao plano
» Cesgranrio distância de ponto a ponto
» Titulação!
» Titulação
» Distância de ponto a reta, de ponto ao plano
» Cesgranrio distância de ponto a ponto
» Titulação!
» Titulação
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|













