Termodinâmica - teoria
2 participantes
PiR2 :: Física :: Termologia
Página 1 de 1
 Termodinâmica - teoria
Termodinâmica - teoria
Verifique as afirmativas abaixo:
I. Se um gás pode evoluir do estado A ao estado B por três caminhos diferentes, o calor trocado
pelo gás depende do caminho seguido pelo gás no percurso AB, sendo tão maior quanto menor
for o trabalho realizado pelo gás;
II. Numa mistura de gases em equilíbrio térmico, terá maior energia cinética média as moléculas dos
gases que tiverem maior massa molecular;
III. Volumes iguais de gases diferentes, nas mesmas condições de temperatura e pressão, contém o
mesmo número de moléculas
Gab.:
I. F
II. F
III. V
Alguém pode me justificar esse gabarito, por favor?
I. Se um gás pode evoluir do estado A ao estado B por três caminhos diferentes, o calor trocado
pelo gás depende do caminho seguido pelo gás no percurso AB, sendo tão maior quanto menor
for o trabalho realizado pelo gás;
II. Numa mistura de gases em equilíbrio térmico, terá maior energia cinética média as moléculas dos
gases que tiverem maior massa molecular;
III. Volumes iguais de gases diferentes, nas mesmas condições de temperatura e pressão, contém o
mesmo número de moléculas
Gab.:
I. F
II. F
III. V
Alguém pode me justificar esse gabarito, por favor?

Ada Augusta- Recebeu o sabre de luz

- Mensagens : 131
Data de inscrição : 08/09/2023
 Re: Termodinâmica - teoria
Re: Termodinâmica - teoria
Afirmação 1: A primeira Lei da Termodinâmica nos diz que [latex]\Delta U = Q - T[/latex], sendo [latex]Q[/latex] o calor trocado com o meio e [latex]T[/latex] o trabalho realizado pelo gás. Quando trabalhamos com os gráficos Pressão x Volume conseguimos ver que o gás realiza diferentes trabalhos a depender do "caminho" que ele segue. De fato, para dois estados termodinâmicos A e B, independente do "caminho" seguido pelo gás a variação da energia interna do sistema é a mesma. Logo, para um maior trabalho teremos que ter uma maior troca de calor com o meio. Quanto menor o trabalho [latex]T[/latex], menor será o calor [latex]Q[/latex] (não maior como diz a afirmação). Exemplo: Se [latex]\Delta U=500J[/latex] realizando um trabalho de [latex]500 J[/latex] então o calor [latex]Q[/latex] deve ser [latex]Q=1000J[/latex]. Porém, se por outro "caminho" o gás realizou um trabalho [latex]T=250J[/latex], então [latex]Q=750J[/latex].
Afirmação 2: Pela primeira Lei da Termodinâmica temos que [latex]\Delta U = \frac{3}{2} \cdot n \cdot R \cdot \Delta T[/latex] sendo [latex]n[/latex] o número de mol (massa da matéria/ massa molar). Logo, quanto maior a massa molar da substância menor será a variação da energia interna. Lembre-se que a energia interna de um gás é a medida da energia cinética média de todas as suas partículas.
Afirmação 3: Pela equação da Clapeyron temos que [latex]P \cdot V = n \cdot R \cdot T[/latex]. Se a pressão P, o volume V e a temperatura T são os mesmos para os dois gases, então temos que [latex]n=\frac{P \cdot V}{R \cdot T}[/latex]. Ou seja, o número de mol é o mesmo para os dois gases, logo terão o mesmo número de moléculas. O número de moléculas é igual ao produto do número de mols [latex]n[/latex] pela constante de Avogrado.
Afirmação 2: Pela primeira Lei da Termodinâmica temos que [latex]\Delta U = \frac{3}{2} \cdot n \cdot R \cdot \Delta T[/latex] sendo [latex]n[/latex] o número de mol (massa da matéria/ massa molar). Logo, quanto maior a massa molar da substância menor será a variação da energia interna. Lembre-se que a energia interna de um gás é a medida da energia cinética média de todas as suas partículas.
Afirmação 3: Pela equação da Clapeyron temos que [latex]P \cdot V = n \cdot R \cdot T[/latex]. Se a pressão P, o volume V e a temperatura T são os mesmos para os dois gases, então temos que [latex]n=\frac{P \cdot V}{R \cdot T}[/latex]. Ou seja, o número de mol é o mesmo para os dois gases, logo terão o mesmo número de moléculas. O número de moléculas é igual ao produto do número de mols [latex]n[/latex] pela constante de Avogrado.
Marcuslevy- Iniciante
- Mensagens : 10
Data de inscrição : 26/01/2023
Ada Augusta gosta desta mensagem
 Re: Termodinâmica - teoria
Re: Termodinâmica - teoria
Entendi as outras, mas essa parte dos diferentes tipos de massa ou quantidade mols/moléculas em gases é bem confusa. A massa molecular é a soma das massas molares do gás, não é? Por isso, se n = m/M, quanto maior M, menor n, logo menor será a variação de energia interna, certo?
Você teria algum material bom que deixe claro essas diferenças? Se quiser e puder, também pode me escrever. Desde já, muito obrigada pela resposta!
Você teria algum material bom que deixe claro essas diferenças? Se quiser e puder, também pode me escrever. Desde já, muito obrigada pela resposta!

Ada Augusta- Recebeu o sabre de luz

- Mensagens : 131
Data de inscrição : 08/09/2023
 Re: Termodinâmica - teoria
Re: Termodinâmica - teoria
Vou tentar explicar de uma maneira mais prática. Imagine que tenhamos um recipiente com dois gases A e B. A questão nos diz que os gases estão em equilíbrio térmico, ou seja, eles possuem a mesma temperatura. Como citei, a energia interna de um gás é dada como [latex]\Delta U= \frac{3}{2} n\cdot R \cdot T[/latex], sendo [latex]R[/latex] a constante universal dos gases. Até aqui ok? Você obtém o número de mol dividindo a massa de cada um dos gases presentes no recipiente pelas suas respectivas massas molares. Os gases A e B são distintos, logo eles possuem massas molares distintas.
Aqui entra um ponto que não me atentei quando respondi a sua pergunta: a questão não nos diz nada à respeito das massas dos gases. Se no recipiente nós assumirmos que existem massas iguais de A e B (vamos denotar por M), o número de mol vai ser maior para o gás que possuir a menor massa molar, logo terá a maior energia interna.
Se estivéssemos trabalhando com [latex]CO_2[/latex] ([latex]44g/mol[/latex]) como o gas A e com [latex]O_2[/latex] ([latex]32g/mol[/latex]) sendo o gás B, percebe que o número de mol do [latex]O_2[/latex] vai ser maior?
[latex]n_A=\frac{M}{44}[/latex] [latex]n_B=\frac{M}{32}[/latex]
Novamente, a informação sobre as massas dos gases não ficou clara. Mas, considerando que as massas sejam iguais, o gás que possuir a menor massa molar terá a maior energia interna.
Se alguém puder ajudar a esclarecer eu agradeço.
Aqui entra um ponto que não me atentei quando respondi a sua pergunta: a questão não nos diz nada à respeito das massas dos gases. Se no recipiente nós assumirmos que existem massas iguais de A e B (vamos denotar por M), o número de mol vai ser maior para o gás que possuir a menor massa molar, logo terá a maior energia interna.
Se estivéssemos trabalhando com [latex]CO_2[/latex] ([latex]44g/mol[/latex]) como o gas A e com [latex]O_2[/latex] ([latex]32g/mol[/latex]) sendo o gás B, percebe que o número de mol do [latex]O_2[/latex] vai ser maior?
[latex]n_A=\frac{M}{44}[/latex] [latex]n_B=\frac{M}{32}[/latex]
Novamente, a informação sobre as massas dos gases não ficou clara. Mas, considerando que as massas sejam iguais, o gás que possuir a menor massa molar terá a maior energia interna.
Se alguém puder ajudar a esclarecer eu agradeço.
Marcuslevy- Iniciante
- Mensagens : 10
Data de inscrição : 26/01/2023
 Re: Termodinâmica - teoria
Re: Termodinâmica - teoria
Eu tentei te enviar uma mensagem privada mas não sei se deu certo, mas fica aqui a minha sugestão.
Existem uma coleção de livros de química da autora Martha Reis que possuem uma linguagem clara e acessível. Você irá encontrar a teoria envolvendo gases e misturas gasosas no volume 2 dessa coleção. Através desse link você consegue fazer o download.
Library Genesis: Martha Reis Marques da Fonseca - Química (libgen.is)
Este não é um livro para aprofundamento, mas sim um livro para fazer uma excelente base para pessoas que possuem dificuldades como você.
Existem uma coleção de livros de química da autora Martha Reis que possuem uma linguagem clara e acessível. Você irá encontrar a teoria envolvendo gases e misturas gasosas no volume 2 dessa coleção. Através desse link você consegue fazer o download.
Library Genesis: Martha Reis Marques da Fonseca - Química (libgen.is)
Este não é um livro para aprofundamento, mas sim um livro para fazer uma excelente base para pessoas que possuem dificuldades como você.
Marcuslevy- Iniciante
- Mensagens : 10
Data de inscrição : 26/01/2023
 Re: Termodinâmica - teoria
Re: Termodinâmica - teoria
A massa molecular é quase o mesmo que a massa molar. A diferença, na realidade, é que a massa molecular é dada em unidade de massa atômica (u.m.a ou u) e a massa molar é dada em g/mol. Vale lembrar também que 1 u = 1,6.10⁻²⁷ kg. Além disso, a energia que a afirmativa se refere é especificamente a energia cinética média de cada partícula, que é dada por:
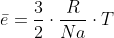
Você pode ver mais sobre nessa imagem aqui:

Assim, podemos perceber que a energia cinética média de cada partícula depende somente da temperatura, dado que o sistema está em equilíbrio térmico, a afirmativa está incorreta.
A respeito da sua mensagem, eu vi sim. Muito obrigada pela ajuda e recomendação, Marcus.
Você pode ver mais sobre nessa imagem aqui:

Assim, podemos perceber que a energia cinética média de cada partícula depende somente da temperatura, dado que o sistema está em equilíbrio térmico, a afirmativa está incorreta.
A respeito da sua mensagem, eu vi sim. Muito obrigada pela ajuda e recomendação, Marcus.

Ada Augusta- Recebeu o sabre de luz

- Mensagens : 131
Data de inscrição : 08/09/2023
Marcuslevy gosta desta mensagem
 Tópicos semelhantes
Tópicos semelhantes» Teoria termodinâmica
» 2° lei da termodinâmica ( teoria )
» Termodinâmica - teoria
» Termodinâmica - teoria
» 2° lei da termodinâmica ( teoria )
» 2° lei da termodinâmica ( teoria )
» Termodinâmica - teoria
» Termodinâmica - teoria
» 2° lei da termodinâmica ( teoria )
PiR2 :: Física :: Termologia
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|













