pH - Uerj 2022
3 participantes
PiR2 :: Química :: Físico-Química
Página 1 de 1
 pH - Uerj 2022
pH - Uerj 2022
Para o tratamento de um resíduo industrial, que corresponde a uma solução aquosa com alta acidez, é utilizado hidróxido de sódio sólido para a elevação do pH. Considere o volume de 10 m3 desse resíduo com concentração de íons H+ de 0,1 mol/L. Desprezando-se a variação de volume, para que essa solução residual alcance pH = 2,0, a massa de hidróxido de sódio, em quilogramas, a ser adicionada é igual a:
(A) 28
(B) 32
(C) 36
(D) 40
Olá, poderiam me mostrar como resolver essa questão?
(A) 28
(B) 32
(C) 36
(D) 40
- GABARITO:
- C
Olá, poderiam me mostrar como resolver essa questão?
Última edição por Ana Laura Guimarães em Dom 15 maio 2022, 17:37, editado 1 vez(es)
 Re: pH - Uerj 2022
Re: pH - Uerj 2022
Se a concentração de íons H+ é de 0,1 mol/L, então, o pH dessa solução residual inicialmente é igual a 1, pois:

Se queremos aumentar o pH para 2, então, devemos consumir parte dos íons de hidrogênio. Mas quanto é necessário? Basta fazer uma simples regra de 3:

Ou seja, se a concentração final de íons hidrogênio é 1/10 da concentração inicial de íons de hidrogênio, então foram consumidos 9/10 da concentração inicial de íons de hidrogênio. Portanto, calculando a quantidade de matéria inicial dos íons de hidrogênio:

Logo:

Dessa forma, foram consumidos 900 mols de íons de hidrogênio. Com essa informação, podemos determinar a quantidade necessária de hidróxido de sódio. Como a dissociação do hidróxido de sódio é de 1:1:1, então, a dissociação do sal será diretamente proporcional à dissociação de íons hidroxila.

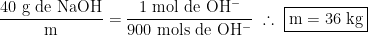
Se queremos aumentar o pH para 2, então, devemos consumir parte dos íons de hidrogênio. Mas quanto é necessário? Basta fazer uma simples regra de 3:
Ou seja, se a concentração final de íons hidrogênio é 1/10 da concentração inicial de íons de hidrogênio, então foram consumidos 9/10 da concentração inicial de íons de hidrogênio. Portanto, calculando a quantidade de matéria inicial dos íons de hidrogênio:
Logo:
Dessa forma, foram consumidos 900 mols de íons de hidrogênio. Com essa informação, podemos determinar a quantidade necessária de hidróxido de sódio. Como a dissociação do hidróxido de sódio é de 1:1:1, então, a dissociação do sal será diretamente proporcional à dissociação de íons hidroxila.

qedpetrich- Monitor

- Mensagens : 2497
Data de inscrição : 05/07/2021
Idade : 24
Localização : Erechim - RS / Passo Fundo - RS
 Re: pH - Uerj 2022
Re: pH - Uerj 2022
Dúvida:qedpetrich escreveu:Se a concentração de íons H+ é de 0,1 mol/L, então, o pH dessa solução residual inicialmente é igual a 1, pois:
Se queremos aumentar o pH para 2, então, devemos consumir parte dos íons de hidrogênio. Mas quanto é necessário? Basta fazer uma simples regra de 3:
Ou seja, se a concentração final de íons hidrogênio é 1/10 da concentração inicial de íons de hidrogênio, então foram consumidos 9/10 da concentração inicial de íons de hidrogênio. Portanto, calculando a quantidade de matéria inicial dos íons de hidrogênio:
Logo:
Dessa forma, foram consumidos 900 mols de íons de hidrogênio. Com essa informação, podemos determinar a quantidade necessária de hidróxido de sódio. Como a dissociação do hidróxido de sódio é de 1:1:1, então, a dissociação do sal será diretamente proporcional à dissociação de íons hidroxila.
Não entendi como você chegou em [H+ final] =10² mols e o [H+ Inicial] = 10³mols
 Re: pH - Uerj 2022
Re: pH - Uerj 2022
Olá, desculpe a demora para responder, estava mal esses dias aí, acabei me ausentando até melhorar.
A concentração inicial, foi calculada a partir do enunciado, veja:
Considere o volume de 10 m³ desse resíduo com concentração de íons H+ de 0,1 mol/L.
Só multipliquei o volume dado com sua concentração, 10 m³ = 10⁴ dm³ → Mas 1 L = 1 dm³ → 10⁴ dm³ = 10⁴ L. Assim:

A concentração final, utilizei a proporção final do pH inicial com o pH final.

Como a concentração inicial já foi determinada, logo:

Dúvidas pontue.
A concentração inicial, foi calculada a partir do enunciado, veja:
Considere o volume de 10 m³ desse resíduo com concentração de íons H+ de 0,1 mol/L.
Só multipliquei o volume dado com sua concentração, 10 m³ = 10⁴ dm³ → Mas 1 L = 1 dm³ → 10⁴ dm³ = 10⁴ L. Assim:
A concentração final, utilizei a proporção final do pH inicial com o pH final.
Como a concentração inicial já foi determinada, logo:
Dúvidas pontue.

qedpetrich- Monitor

- Mensagens : 2497
Data de inscrição : 05/07/2021
Idade : 24
Localização : Erechim - RS / Passo Fundo - RS
Ana Laura Guimarães gosta desta mensagem
 Re: pH - Uerj 2022
Re: pH - Uerj 2022
Olá, espero que tenha melhoradoqedpetrich escreveu:Olá, desculpe a demora para responder, estava mal esses dias aí, acabei me ausentando até melhorar.
A concentração inicial, foi calculada a partir do enunciado, veja:
Considere o volume de 10 m³ desse resíduo com concentração de íons H+ de 0,1 mol/L.
Só multipliquei o volume dado com sua concentração, 10 m³ = 10⁴ dm³ → Mas 1 L = 1 dm³ → 10⁴ dm³ = 10⁴ L. Assim:
A concentração final, utilizei a proporção final do pH inicial com o pH final.
Como a concentração inicial já foi determinada, logo:
Dúvidas pontue.

Muito obrigada pela explicação, consegui entender agora
qedpetrich gosta desta mensagem
 Re: pH - Uerj 2022
Re: pH - Uerj 2022
Entendi a resolução. Porém, gostaria de entender por que a minha resolução não chega à resposta correta.
O volume [latex]V = 10\text m ^3 = 10^4 \text L[/latex].
De início, podemos encontrar o número de mols de OH através do pH:
[latex]\text{pH} = 1 \Rightarrow \text{pOH} = 13 \Rightarrow [\text{OH}^-] = 10^{-13} \text { mol/L}[/latex]
[latex]n_{\text{OH}} = [\text{OH}^-]\cdot V = 10^{-13} \cdot 10^{4} = 10^{-9} \text { mol de OH}[/latex]
A situação desejada será:
[latex]\text{pH} = 2 \Rightarrow \text{pOH} = 12 \Rightarrow [\text{OH}^-] = 10^{-12} \text{ mol/L}[/latex]
[latex]n_{\text{OH}}' = [\text{OH}^-]\cdot V = 10^{-12}\cdot 10^4 = 10^8 \text { mol de OH}[/latex]
Portanto, se ganham [latex]10^{-8} - 10^{-9} = 9\cdot 10^{-9} \text { mol de OH}[/latex].
Cada mol de hidróxido de sódio produz um mol de OH:
[latex]\text{NaOH} \rightarrow \text{Na}^+ + \text{OH}^-[/latex]
Portanto, devem ser adicionados [latex]9 \cdot 10^{-9}[/latex] mol de NaOH.
Como a massa molar de NaOH é de 40g/mol, temos:
[latex]m = 9\cdot 10^{-9} \cdot 40 \text g = 36 \cdot 10^{-8} \text g = 36 \cdot 10^{-11} \text{kg}[/latex]
O que fiz de errado?
O volume [latex]V = 10\text m ^3 = 10^4 \text L[/latex].
De início, podemos encontrar o número de mols de OH através do pH:
[latex]\text{pH} = 1 \Rightarrow \text{pOH} = 13 \Rightarrow [\text{OH}^-] = 10^{-13} \text { mol/L}[/latex]
[latex]n_{\text{OH}} = [\text{OH}^-]\cdot V = 10^{-13} \cdot 10^{4} = 10^{-9} \text { mol de OH}[/latex]
A situação desejada será:
[latex]\text{pH} = 2 \Rightarrow \text{pOH} = 12 \Rightarrow [\text{OH}^-] = 10^{-12} \text{ mol/L}[/latex]
[latex]n_{\text{OH}}' = [\text{OH}^-]\cdot V = 10^{-12}\cdot 10^4 = 10^8 \text { mol de OH}[/latex]
Portanto, se ganham [latex]10^{-8} - 10^{-9} = 9\cdot 10^{-9} \text { mol de OH}[/latex].
Cada mol de hidróxido de sódio produz um mol de OH:
[latex]\text{NaOH} \rightarrow \text{Na}^+ + \text{OH}^-[/latex]
Portanto, devem ser adicionados [latex]9 \cdot 10^{-9}[/latex] mol de NaOH.
Como a massa molar de NaOH é de 40g/mol, temos:
[latex]m = 9\cdot 10^{-9} \cdot 40 \text g = 36 \cdot 10^{-8} \text g = 36 \cdot 10^{-11} \text{kg}[/latex]
O que fiz de errado?
∑davigole- Iniciante
- Mensagens : 12
Data de inscrição : 08/12/2023
Idade : 17
 Tópicos semelhantes
Tópicos semelhantes» óxidos - UERJ 2022
» Uerj 2022 - Probabilidade
» Concentração de Íons - Uerj 2022
» Eletrólise - UEM 2022
» Densidade e propriedade dos líquidos - Uerj 2022
» Uerj 2022 - Probabilidade
» Concentração de Íons - Uerj 2022
» Eletrólise - UEM 2022
» Densidade e propriedade dos líquidos - Uerj 2022
PiR2 :: Química :: Físico-Química
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|














