Eletroquímica - pilhas
2 participantes
PiR2 :: Química :: Físico-Química
Página 1 de 1
 Eletroquímica - pilhas
Eletroquímica - pilhas
O potencial normal da célula seguinte é 0,23v a 15°C e 0,21 a 35ºC.
/HCl(aq)\parallel&space;AgCl(s)Ag(s))
Dado: Ag+/Ag Eº=0,80
a) Escreva a reação global da célula galvânica
b) Calcule o ΔH° e o ΔS° para a reação da célula?
Respostas: a) 2AgCl + H2 -> 2Ag + 2H+ + 2Cl- b) ΔS°= -193K/K ΔH°= -99974J
Estou tendo dificuldades na letra ''b''. Como relaciono Delta s com delta H e com delta E? :scratch:
Dado: Ag+/Ag Eº=0,80
a) Escreva a reação global da célula galvânica
b) Calcule o ΔH° e o ΔS° para a reação da célula?
Respostas: a) 2AgCl + H2 -> 2Ag + 2H+ + 2Cl- b) ΔS°= -193K/K ΔH°= -99974J
Estou tendo dificuldades na letra ''b''. Como relaciono Delta s com delta H e com delta E? :scratch:

Liebert- Padawan

- Mensagens : 58
Data de inscrição : 17/07/2016
Idade : 26
Localização : Pará
 Re: Eletroquímica - pilhas
Re: Eletroquímica - pilhas
Você os relaciona através da Energia Livre de Gibbs.
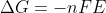

A questão fornece o potencial da pilha para duas temperaturas diferentes, sendo que nenhuma corresponde à temperatura padrão. Assim, os valores de e
e  serão diferentes para cada uma das situações e não corresponderão aos valores padrão. Porém, como delta H e delta S variam muito pouco com a alteração temperatura, consideraremos para essa questão que essas variáveis serão iguais para T1 e T2, e que correspondem às condições padrão. Portanto :
serão diferentes para cada uma das situações e não corresponderão aos valores padrão. Porém, como delta H e delta S variam muito pouco com a alteração temperatura, consideraremos para essa questão que essas variáveis serão iguais para T1 e T2, e que correspondem às condições padrão. Portanto :
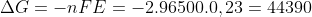
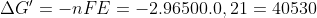
E :
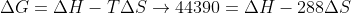
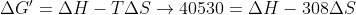
Resolvendo o sistema, descobrimos que
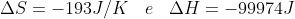
A questão fornece o potencial da pilha para duas temperaturas diferentes, sendo que nenhuma corresponde à temperatura padrão. Assim, os valores de
E :
Resolvendo o sistema, descobrimos que
André Meneses- Recebeu o sabre de luz

- Mensagens : 173
Data de inscrição : 12/07/2016
Idade : 22
Localização : Natal - RN
 Tópicos semelhantes
Tópicos semelhantes» eletroquímica - Pilhas
» |Eletroquímica| - Pilhas
» Pilhas - Eletroquímica
» Pilhas - eletroquímica
» Eletroquímica - Pilhas
» |Eletroquímica| - Pilhas
» Pilhas - Eletroquímica
» Pilhas - eletroquímica
» Eletroquímica - Pilhas
PiR2 :: Química :: Físico-Química
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|













