Equilibrio Quimico
3 participantes
Página 1 de 1
 Equilibrio Quimico
Equilibrio Quimico
Considere o equilíbrio a seguir, que corresponde à obtenção de ácido nítrico a partir da reação de oxidação da amônia.
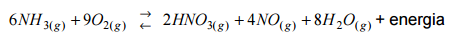
É INCORRETO afirmar que:
a) a constante de equilíbrio diminui com o aumento da temperatura.
b) a constante de equilíbrio aumenta com o aumento da pressão.
c) um aumento da temperatura deslocará o equilíbrio em direção aos reagentes.
d) um aumento de pressão deslocará o equilíbrio em direção aos produtos da reação.
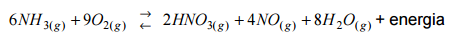
É INCORRETO afirmar que:
a) a constante de equilíbrio diminui com o aumento da temperatura.
b) a constante de equilíbrio aumenta com o aumento da pressão.
c) um aumento da temperatura deslocará o equilíbrio em direção aos reagentes.
d) um aumento de pressão deslocará o equilíbrio em direção aos produtos da reação.

EstudanteCiencias- Jedi

- Mensagens : 358
Data de inscrição : 17/07/2016
Idade : 24
Localização : Salvador - Bahia
 Re: Equilibrio Quimico
Re: Equilibrio Quimico
A letra B está errada, pois o único fator que modifica a constante de equilíbrio (em valores) é a alteração na temperatura do equilíbrio.

Giovana Martins- Grande Mestre

- Mensagens : 7606
Data de inscrição : 15/05/2015
Idade : 23
Localização : São Paulo
 Re: Equilibrio Quimico
Re: Equilibrio Quimico
Giovanna Martins, eu to confundindo um pouco esse assunto, mas veja bem, se o aumento de pressao favorece reação direta, não haveria um aumento da concentração dos produtos em dentrimento da concentração dos reagentes e, portanto, a constante de equilibrio não deveria aumentar?

EstudanteCiencias- Jedi

- Mensagens : 358
Data de inscrição : 17/07/2016
Idade : 24
Localização : Salvador - Bahia
 Re: Equilibrio Quimico
Re: Equilibrio Quimico
Olha, moço (a), vou ser sincera com você, já busquei essa explicação em diversos lugares e nunca a encontrei. Dei uma pesquisada pelo Usberco e Salvador e, também, pelo Ricardo Feltre e, em nenhum deles encontra-se a explicação para a sua dúvida. Pesquisando pela internet eu achei isto (link) que, talvez, explique a sua dúvida. Está na parte de "compressão de uma mistura". Confesso que a sua dúvida também me intriga.
Enfim, acho que esta eu ficarei te devendo .
.
Enfim, acho que esta eu ficarei te devendo

Giovana Martins- Grande Mestre

- Mensagens : 7606
Data de inscrição : 15/05/2015
Idade : 23
Localização : São Paulo
 Re: Equilibrio Quimico
Re: Equilibrio Quimico
Aumento de pressão aumenta a concentração do lado da equação que possui menor volume (como nesse caso o sistema é gasoso e ideal, quem tiver a menor soma de moles). A constante de equilíbrio é constante, pois enquanto aumenta a concentração de produtos, diminui a de reagentes. Só mudará de constante quando há entrada ou saída de energia no sistema.
Convidado- Convidado
 Re: Equilibrio Quimico
Re: Equilibrio Quimico
A constante de equilíbrio só muda com a temperatura:EstudanteCiencias escreveu:Giovanna Martins, eu to confundindo um pouco esse assunto, mas veja bem, se o aumento de pressao favorece reação direta, não haveria um aumento da concentração dos produtos em dentrimento da concentração dos reagentes e, portanto, a constante de equilibrio não deveria aumentar?
O corre que, instantaneamente, teremos o aumento ou a diminuição da concentração de reagentes ou produtos devido a alguma alteração no sistema, no entanto, com o passar do tempo, as concentrações se equilibrarão novamente, de tal forma que a constante de equilíbrio permaneça igual.
Veja esse gráfico:

Até o instante t1, o sistema estava em equilíbrio. Com a introdução de mais N2, aumentando sua concentração, os demais componentes da reação se reajustarão para compensar essa mudança e estabelecerem-se novamente em equilíbrio.
Se formos estipular um valor para a "constante de equilíbrio" entre t1 e t2, não obteremos Kc, mas sim Qc, que se refere a um valor instantâneo para a mesma fórmula da contante de equilíbrio, mas sem o sistema estar em equilíbrio, o que só ocorre a partir de t2.
____________________________________________
"Death is so terribly final, while life is full of possibilities." - Tyrion Lannister
 Re: Equilibrio Quimico
Re: Equilibrio Quimico
Pre-Iteano, então a constante de equilibrio nos instantes anteriores à T1 é equivalente a constante de equilibrio nos instantes posteriores a T2 e, entre o instante T1 e T2, a razão Q = ( [NH3]² )/( [N2].[H2]³ ) aproxima-se, a cada instante, da constante de equilibrio. É isso?
Outra coisa, na formula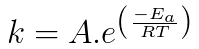 , o que é "A" e "Ea" ?
, o que é "A" e "Ea" ?
Outra coisa, na formula
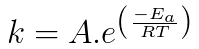 , o que é "A" e "Ea" ?
, o que é "A" e "Ea" ?
EstudanteCiencias- Jedi

- Mensagens : 358
Data de inscrição : 17/07/2016
Idade : 24
Localização : Salvador - Bahia
 Re: Equilibrio Quimico
Re: Equilibrio Quimico
"A" é uma constante que depende da reação (constante de Arrhenius).
"Ea" é a energia de ativação da reação.
Enquanto o sistema estiver em equilíbrio (antes de t1 e após t2), k será o mesmo. Você entendeu bem.
"Ea" é a energia de ativação da reação.
Enquanto o sistema estiver em equilíbrio (antes de t1 e após t2), k será o mesmo. Você entendeu bem.
____________________________________________
"Death is so terribly final, while life is full of possibilities." - Tyrion Lannister
 Re: Equilibrio Quimico
Re: Equilibrio Quimico
Pre-Iteano, só mais uma duvida: A partir da formula, concluimos que a temperatura, ao contrario da pressao, influencia na constante de equilibrio. Beleza! Mas por que isso ocorre? Quero dizer, por que quando alteramos a pressão, "os componentes da reação se reajustam para compensar essa mudança e estabelecerem-se novamente em equilíbrio" mas quando alteramos a temperatura os componentes não se reajustam? Por que o reajuste ocorre para a pressao mas não para a temperatura?

EstudanteCiencias- Jedi

- Mensagens : 358
Data de inscrição : 17/07/2016
Idade : 24
Localização : Salvador - Bahia
 Tópicos semelhantes
Tópicos semelhantes» Equilíbrio químico
» Equilíbrio químico
» Equilíbrio Químico
» Equilíbrio químico
» equilíbrio químico
» Equilíbrio químico
» Equilíbrio Químico
» Equilíbrio químico
» equilíbrio químico
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|














