Cálculo estequiométrico
2 participantes
Página 1 de 1
 Cálculo estequiométrico
Cálculo estequiométrico
2,5 g de uma mistura de cloreto de amônio e carbonato de sódio são tratadas pelo H2SO4 até completa transformação. Adicionando-se solução de AgNO3 obtém-se um precipitado que depois de lavado e seco pesou 3,5 g. Qual a composição centesimal da mistura, sabendo-se que a mesma contém 20% de impurezas inatacáveis pelo H2SO4.
Então... Nessa questão a dificuldade já aparece até para prever as reações.
Acredito que seja algo do tipo:
_{2}SO_{4}&space;+&space;2HCl)
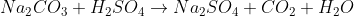
Mas não sei como continuar...
Então... Nessa questão a dificuldade já aparece até para prever as reações.
Acredito que seja algo do tipo:
Mas não sei como continuar...

Gianluigi- Padawan

- Mensagens : 72
Data de inscrição : 25/04/2013
Idade : 30
Localização : Curitiba, PR , Brasil
 Re: Cálculo estequiométrico
Re: Cálculo estequiométrico
Com os dados apresentados, pode-se deduzir que:
Sabendo de tudo isso, com mais algumas regras de três, descobre-se que 1,3g representam 52% de 2,5g. Como 20% são impurezas, restam 28% de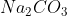 .
.
Por fim:
- 52% de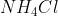 ;
;
- 28% de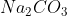 ;
;
- 20% de impurezas.
Se quiser saber qual a porcentagem APENAS DA MISTURA, a resolução tá em baixo. Se quiser saber junto com as impurezas, nem precisa ler o que vem a seguir.
Após a realização de mais uma regra de três, descobre-se qual a massa, em gramas, de mistura existem na substância, sabendo-se que 20% são impurezas. A massa é de 2g. Finalmente, a mistura possui a seguinte composição:
- 65% de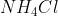 ;
;
- 35% de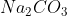 .
.
Portanto, 36,5g de 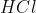 formam 143,5g de
formam 143,5g de 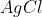 . Como sabemos, pelo enunciado da questão, que formou-se 3,5g de precipitado, basta uma simples regra de três para descobrir que foram utilizados 0,89g de
. Como sabemos, pelo enunciado da questão, que formou-se 3,5g de precipitado, basta uma simples regra de três para descobrir que foram utilizados 0,89g de 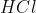 na reação.
na reação.
Voltando à reação inicial, tem-se que 107g de 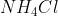 reagem com 73g de
reagem com 73g de 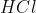 . Portanto, sabendo pelos cálculos já realizados que foram utilizados 0,89g de
. Portanto, sabendo pelos cálculos já realizados que foram utilizados 0,89g de 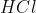 na reação, basta uma regra de três pra descobrir que existiam 1,3g de
na reação, basta uma regra de três pra descobrir que existiam 1,3g de 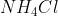 na mistura inicial.
na mistura inicial.
Sabendo de tudo isso, com mais algumas regras de três, descobre-se que 1,3g representam 52% de 2,5g. Como 20% são impurezas, restam 28% de
Por fim:
- 52% de
- 28% de
- 20% de impurezas.
Se quiser saber qual a porcentagem APENAS DA MISTURA, a resolução tá em baixo. Se quiser saber junto com as impurezas, nem precisa ler o que vem a seguir.
Após a realização de mais uma regra de três, descobre-se qual a massa, em gramas, de mistura existem na substância, sabendo-se que 20% são impurezas. A massa é de 2g. Finalmente, a mistura possui a seguinte composição:
- 65% de
- 35% de
Última edição por Chries em Seg 06 Abr 2015, 05:44, editado 5 vez(es)
 Tópicos semelhantes
Tópicos semelhantes» Cálculo Estequiométrico
» calculo estequiometrico 2
» Calculo Estequiométrico
» Cálculo Estequiométrico
» calculo estequiometrico
» calculo estequiometrico 2
» Calculo Estequiométrico
» Cálculo Estequiométrico
» calculo estequiometrico
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos













