Cinetica dos Gases
2 participantes
PiR2 :: Física :: Termologia
Página 1 de 2
Página 1 de 2 • 1, 2 
 Cinetica dos Gases
Cinetica dos Gases
Ola , minha apostila aponta que nao devemos confundir "velocidade media quadratica " com velocidade media ao quadrado, por que?
Pelo que entendi, velocidade media quadratica seria a velocidade EM TODAS AS 3 DIMENSOES de uma moleculas do gas , essa por sua vez deve ser calculada assim v2= vx2 + vy2+ vz2 , isso poruqe se fizermos apenas em duas dimensoes seria o triangulo de pitagoras, e adicionando mais uma dimensao , teremos essa antiga velocidade resultante sendo o cateto do novo triangulo de pitagoras , estou errada?
Pelo que entendi, velocidade media quadratica seria a velocidade EM TODAS AS 3 DIMENSOES de uma moleculas do gas , essa por sua vez deve ser calculada assim v2= vx2 + vy2+ vz2 , isso poruqe se fizermos apenas em duas dimensoes seria o triangulo de pitagoras, e adicionando mais uma dimensao , teremos essa antiga velocidade resultante sendo o cateto do novo triangulo de pitagoras , estou errada?
Maria Pietra Negrão- Padawan

- Mensagens : 86
Data de inscrição : 19/11/2020
 Re: Cinetica dos Gases
Re: Cinetica dos Gases
Olá Maria.
Vejamos a diferença:
Vamos considerar a energia cinética do gás, não de uma molécula, de todo o gás.
[latex]Ec=m\frac{v^2}{2}[/latex]
m= massa do gás
v= ??????
Velocidade do gás?
Não tem como definir uma velocidade para o gás, o melhor modo é aproximar.
Em vez de pensar assim, a abordagem que vamos tomar é a seguinte:
[latex]Ec_{gas}=Ec_1+Ec_2+...Ec_n=\sum_{i=1}^{n}Ec_i[/latex]
Fica assim:
[latex]Ec_{molecula}=\frac{\sum_{i=1}^{n}\frac{m}{2}v_ i^2}{N}=\frac{m}{2}(\frac{v_1^2+...v_n^2}{N})[/latex]
Aqui, é considerado que a energia cinética de cada molécula é a energia cinética do gás dividido pelo número de moléculas. Note que isso significa que toda molécula tem mesma energia cinética, na realidade sabemos que isso é bem diferente, podemos ver isso na distribuição de Maxwell-Boltzmann, mas usar essa ideia é uma boa aproximação que gera bons resultados.
O termo [latex]\frac{v_1^2+v_2^2+...v_n^2}{N}[/latex] surge naturalmente e é chamado de velocidade média quadrática devido aos termos ao quadrado.
Note: [latex]\frac{v_1^2+v_2^2+...v_n^2}{N}\neq (\frac{v_1+v_2+...v_n}{N})^2[/latex]
A esquerda a velocidade média quadrática, a direita a velocidade média ao quadrado.
Nota: você está certa sim.
Vejamos a diferença:
Vamos considerar a energia cinética do gás, não de uma molécula, de todo o gás.
[latex]Ec=m\frac{v^2}{2}[/latex]
m= massa do gás
v= ??????
Velocidade do gás?
Não tem como definir uma velocidade para o gás, o melhor modo é aproximar.
Em vez de pensar assim, a abordagem que vamos tomar é a seguinte:
[latex]Ec_{gas}=Ec_1+Ec_2+...Ec_n=\sum_{i=1}^{n}Ec_i[/latex]
Fica assim:
[latex]Ec_{molecula}=\frac{\sum_{i=1}^{n}\frac{m}{2}v_ i^2}{N}=\frac{m}{2}(\frac{v_1^2+...v_n^2}{N})[/latex]
Aqui, é considerado que a energia cinética de cada molécula é a energia cinética do gás dividido pelo número de moléculas. Note que isso significa que toda molécula tem mesma energia cinética, na realidade sabemos que isso é bem diferente, podemos ver isso na distribuição de Maxwell-Boltzmann, mas usar essa ideia é uma boa aproximação que gera bons resultados.
O termo [latex]\frac{v_1^2+v_2^2+...v_n^2}{N}[/latex] surge naturalmente e é chamado de velocidade média quadrática devido aos termos ao quadrado.
Note: [latex]\frac{v_1^2+v_2^2+...v_n^2}{N}\neq (\frac{v_1+v_2+...v_n}{N})^2[/latex]
A esquerda a velocidade média quadrática, a direita a velocidade média ao quadrado.
Nota: você está certa sim.
____________________________________________
El Álgebra no es más que Geometría y la Geometría no es más que Álgebra abstracta
Sophie Germain
Sophie Germain
Emanuel Dias- Monitor

- Mensagens : 1703
Data de inscrição : 15/12/2018
Idade : 22
Localização : São Paulo
Maria Pietra Negrão gosta desta mensagem
Maria Pietra Negrão- Padawan

- Mensagens : 86
Data de inscrição : 19/11/2020
Emanuel Dias gosta desta mensagem
 Re: Cinetica dos Gases
Re: Cinetica dos Gases
Maria esse conceito se extende.
Veja: (notação de velocidade média quadrática = [latex]\overline{v}^2[/latex])
[latex]\overline{v_x}^2=\frac{\overline{v_x_1}^2+...\overline{v_x_n}^2}{N}[/latex]
olhe bem para expressão.
A velocidade média quadrática no eixo x é a soma do quadrado das velocidades em x dividido pelo número de moléculas.
analogamente para y e z
o que o seu livro disse, é simplesmente que
[latex]\overline{v_x}^2=\overline{v_y}^2=\overline{v_z}^2[/latex]
Aqui que você está se confundindo.
[latex]\overline{v}^2\neq v^2[/latex]
v sem traço é para uma molécula e a expressão ocorre devido a álgebra vetorial, v com traço é uma média dimensional de velocidades, aquela igualdade é verdade por mera aproximação, só pelo fato de não haver privilégio de direção, elas são bem próximas. Veja que a motivação matemática para as igualdades são completamente diferentes.
e generalizou chamando de v qualquer.
[latex]\overline{v_x}^2=\overline{v_y}^2=\overline{v_z}^2=\overline{v}^2[/latex]
[latex]\overline{v}^2=\overline{v_x}^2+\overline{v_y}^2+\overline{v_z}^2\Rightarrow \frac{1}{3}\overline{v}^2=\overline{v_x}^2[/latex]
por isso todos os termos tem o tracinho de velocidade média quadrática, não significa que ele adotou para cada molécula, mas adotou para cada dimensão.
O que eu concordei com você e você disse foi que:
v²=vx²+vy²+vz²
sem o traço, isso aqui é válido para apenas uma molécula, é um fato da matemática vetorial, mas isso é diferente de [latex]\overline{v}^2=\overline{v_x}^2+\overline{v_y}^2+\overline{v_z}^2[/latex]
Se fossem iguais não haveria a necessidade do traço.
Ficou claro?
Seu livro fez a velocidade média quadrática em cada dimensão e assumiu que elas são iguais (numericamente, note que a velocidade média quadrática é um número, que resulta da soma dos quadrados da velocidade dividido pelo número de moléculas, não um vetor, embora na fórmula seja encarada como vetor).
Se ainda tiver dúvidas pode perguntar.
Veja: (notação de velocidade média quadrática = [latex]\overline{v}^2[/latex])
[latex]\overline{v_x}^2=\frac{\overline{v_x_1}^2+...\overline{v_x_n}^2}{N}[/latex]
olhe bem para expressão.
A velocidade média quadrática no eixo x é a soma do quadrado das velocidades em x dividido pelo número de moléculas.
analogamente para y e z
o que o seu livro disse, é simplesmente que
[latex]\overline{v_x}^2=\overline{v_y}^2=\overline{v_z}^2[/latex]
Aqui que você está se confundindo.
[latex]\overline{v}^2\neq v^2[/latex]
v sem traço é para uma molécula e a expressão ocorre devido a álgebra vetorial, v com traço é uma média dimensional de velocidades, aquela igualdade é verdade por mera aproximação, só pelo fato de não haver privilégio de direção, elas são bem próximas. Veja que a motivação matemática para as igualdades são completamente diferentes.
e generalizou chamando de v qualquer.
[latex]\overline{v_x}^2=\overline{v_y}^2=\overline{v_z}^2=\overline{v}^2[/latex]
[latex]\overline{v}^2=\overline{v_x}^2+\overline{v_y}^2+\overline{v_z}^2\Rightarrow \frac{1}{3}\overline{v}^2=\overline{v_x}^2[/latex]
por isso todos os termos tem o tracinho de velocidade média quadrática, não significa que ele adotou para cada molécula, mas adotou para cada dimensão.
O que eu concordei com você e você disse foi que:
v²=vx²+vy²+vz²
sem o traço, isso aqui é válido para apenas uma molécula, é um fato da matemática vetorial, mas isso é diferente de [latex]\overline{v}^2=\overline{v_x}^2+\overline{v_y}^2+\overline{v_z}^2[/latex]
Se fossem iguais não haveria a necessidade do traço.
Ficou claro?
Seu livro fez a velocidade média quadrática em cada dimensão e assumiu que elas são iguais (numericamente, note que a velocidade média quadrática é um número, que resulta da soma dos quadrados da velocidade dividido pelo número de moléculas, não um vetor, embora na fórmula seja encarada como vetor).
Se ainda tiver dúvidas pode perguntar.
____________________________________________
El Álgebra no es más que Geometría y la Geometría no es más que Álgebra abstracta
Sophie Germain
Sophie Germain
Emanuel Dias- Monitor

- Mensagens : 1703
Data de inscrição : 15/12/2018
Idade : 22
Localização : São Paulo
 Re: Cinetica dos Gases
Re: Cinetica dos Gases
Novamente, desculpe o incomodo e obrigada mesmo por me responder ,
Entao , fiquei um pouco confusa, qual foi a diferenca nessa parte da velocidade desse livro que te mandei para essa demonstracao aqui: Por que um usou o traco e o outro nao ? Esta correto nao usar? Porque assim, no final v2 vai ser igual a v2 (com traco) nao vai?!

Entao , fiquei um pouco confusa, qual foi a diferenca nessa parte da velocidade desse livro que te mandei para essa demonstracao aqui: Por que um usou o traco e o outro nao ? Esta correto nao usar? Porque assim, no final v2 vai ser igual a v2 (com traco) nao vai?!

Maria Pietra Negrão- Padawan

- Mensagens : 86
Data de inscrição : 19/11/2020
 Re: Cinetica dos Gases
Re: Cinetica dos Gases
Não é igual, a apostila não usou o traço mas isso é falta de rigorosidade na demonstração. Como pode ver o Tópicos usou.
vx sem traço significa a velocidade no eixo x de alguma molécula, de apenas uma
vx com traço (traço indica velocidade média quadrática), [latex]\overline{v_x}=\sqrt{\frac{v_x_1^2+...+v_x_n^2}{N}}[/latex]
vx é o vetor velocidade de uma molécula no eixo x, vx com traço é a expressão ali em cima, duas coisas completamente diferente.
Livros de ensino superior costumam usar a notação para velocidade média quadrática.
[latex]<\overline{v}^2>=\frac{v_1^2+v_2^2+...v_n^2}{n}[/latex]
v² pode ser simplesmente a velocidade de uma molécula.
Em outras palavras, pode fazer igual foi feito na apostila, mas tem que deixar claro que v² é a velocidade média quadrática por texto, assim como todo livro faz, usando ou traço ou sinal de desigualdade para diferenciar.
[latex]<\overline{v}^2>=\frac{v_1^2+v_2^2+...v_n^2}{n}=\frac{v_x_1^2+...v_x_n^2}{n}+\frac{v_y_1^2+...v_y_n^2}{n}+\frac{v_z_1^2+...v_z_n^2}{n}[/latex]
Interprete velocidade quadrática média como um número, não como um vetor.
Olhando a expressão ali em cima, o que eu escrevi é que:
[latex]\overline{v}^2=\overline{v_x}^2+\overline{v_y}^2+\overline{v_z}^2[/latex]
Como aproximação, tanto o Tópicos de Física quanto a apostila assumiram que:
[latex]\overline{v_x}^2=\overline{v_y}^2=\overline{v_z}^2[/latex]
logo:
[latex]\frac{v_x_1^2+...+v_x_n^2}{n}=\frac{v_y_1^2+...+v_y_n^2}{n}=\frac{v_z_1^2+...+v_z_n^2}{n}[/latex]
então, na primeira expressão:
[latex]\overline{v}^2=3(\frac{v_x_1^2+...v_x_n^2}{n})=3\overline{v_x}^2[/latex]
Não sei se ficou claro agora, mas há sim, diferença entre a velocidade média quadrática e a velocidade de uma molécula.
Não há porque pedir desculpas, eu adoro tentar ajudar, e se ainda não entendeu, continue perguntando até entender.
vx sem traço significa a velocidade no eixo x de alguma molécula, de apenas uma
vx com traço (traço indica velocidade média quadrática), [latex]\overline{v_x}=\sqrt{\frac{v_x_1^2+...+v_x_n^2}{N}}[/latex]
vx é o vetor velocidade de uma molécula no eixo x, vx com traço é a expressão ali em cima, duas coisas completamente diferente.
Livros de ensino superior costumam usar a notação para velocidade média quadrática.
[latex]<\overline{v}^2>=\frac{v_1^2+v_2^2+...v_n^2}{n}[/latex]
v² pode ser simplesmente a velocidade de uma molécula.
Em outras palavras, pode fazer igual foi feito na apostila, mas tem que deixar claro que v² é a velocidade média quadrática por texto, assim como todo livro faz, usando ou traço ou sinal de desigualdade para diferenciar.
[latex]<\overline{v}^2>=\frac{v_1^2+v_2^2+...v_n^2}{n}=\frac{v_x_1^2+...v_x_n^2}{n}+\frac{v_y_1^2+...v_y_n^2}{n}+\frac{v_z_1^2+...v_z_n^2}{n}[/latex]
Interprete velocidade quadrática média como um número, não como um vetor.
Olhando a expressão ali em cima, o que eu escrevi é que:
[latex]\overline{v}^2=\overline{v_x}^2+\overline{v_y}^2+\overline{v_z}^2[/latex]
Como aproximação, tanto o Tópicos de Física quanto a apostila assumiram que:
[latex]\overline{v_x}^2=\overline{v_y}^2=\overline{v_z}^2[/latex]
logo:
[latex]\frac{v_x_1^2+...+v_x_n^2}{n}=\frac{v_y_1^2+...+v_y_n^2}{n}=\frac{v_z_1^2+...+v_z_n^2}{n}[/latex]
então, na primeira expressão:
[latex]\overline{v}^2=3(\frac{v_x_1^2+...v_x_n^2}{n})=3\overline{v_x}^2[/latex]
Não sei se ficou claro agora, mas há sim, diferença entre a velocidade média quadrática e a velocidade de uma molécula.
Não há porque pedir desculpas, eu adoro tentar ajudar, e se ainda não entendeu, continue perguntando até entender.
____________________________________________
El Álgebra no es más que Geometría y la Geometría no es más que Álgebra abstracta
Sophie Germain
Sophie Germain
Emanuel Dias- Monitor

- Mensagens : 1703
Data de inscrição : 15/12/2018
Idade : 22
Localização : São Paulo
Maria Pietra Negrão gosta desta mensagem
 Re: Cinetica dos Gases
Re: Cinetica dos Gases
Maria Pietra Negrão escreveu:Novamente, desculpe o incomodo e obrigada mesmo por me responder ,
Entao , fiquei um pouco confusa, qual foi a diferenca nessa parte da velocidade desse livro que te mandei para essa demonstracao aqui: Por que um usou o traco e o outro nao ? Esta correto nao usar? Porque assim, no final v2 vai ser igual a v2 (com traco) nao vai?!
Vamos usar o desenho, olha ali na figura do Tópicos tem um vetor v representado.
Aquele vetor v é a velocidade de uma molécula.
v traço é a velocidade média quadrática.
Vamos diferenciar as duas:
v é a velocidade real da molécula,
v traço é uma aproximação, pode ser bem diferente ou pode ser a mesma coisa, para algumas moléculas v traço e v são quase o mesmo valor, para outras a diferença é grande.
Isso ocorre porque em um gás, a velocidade de uma molécula não é tão bem definida, varia em um grande intervalo, algumas podem ser relativamente lentas, outras muito rápidas, v traço é uma média disso tudo. Acontece que , a que tem velocidade baixa tem energia cinética baixa, a que tem velocidade alta tem energia cinética alta, tomando a média quadrática, a energia cinética total é aproximadamente essa soma de energia cinética.
____________________________________________
El Álgebra no es más que Geometría y la Geometría no es más que Álgebra abstracta
Sophie Germain
Sophie Germain
Emanuel Dias- Monitor

- Mensagens : 1703
Data de inscrição : 15/12/2018
Idade : 22
Localização : São Paulo
 Re: Cinetica dos Gases
Re: Cinetica dos Gases
Veja esse gráfico, ele vai te ajudar.
Isso é a distribuição de velocidades de moléculas em um gás, quanto maior a curva, mais moléculas possui essa velocidade.
Olhe para o gás vermelho. Veja que uma pequena parte das moléculas tem velocidade quase zero, enquanto outras tem velocidades de 800 m/s, varia absurdamente, umas tem energia cinética quase zero e a outra bem maior, como calcular a energia do gás então? Usamos a velocidade média quadrática, que é uma média de tudo isso ae, e aproxima a energia cinética do gás sem ter que calcular para cada uma delas.
____________________________________________
El Álgebra no es más que Geometría y la Geometría no es más que Álgebra abstracta
Sophie Germain
Sophie Germain
Emanuel Dias- Monitor

- Mensagens : 1703
Data de inscrição : 15/12/2018
Idade : 22
Localização : São Paulo
Maria Pietra Negrão gosta desta mensagem
 Re: Cinetica dos Gases
Re: Cinetica dos Gases
Emanuel, eu novamente... hahha
Primeiro queria agradecer , segundo queria esclarecer o que eu estava com duvida para ver se entendi:
Primeira pergunta: a logica seria usarmos a velocidade media ao quadrado , certo? Porem por ser de dificil calculo, utiliza-se a velocidade media quadratica, que e proxima da velocidade media ao quadrado, correto?
Segunda pergunta: Para a minha apostila (que nao usou a notacao com traco, podemos dizer que ela considerou que a velocidade de uma so particula nas tres dimensoes seria a velocidade media, que por sua vez no Topicos foi usado como sendo a velocidade media quadratica , estou correta?
ENFIM, SERIO AGRADECO MUITOOOO DESDE JA !!
Primeiro queria agradecer , segundo queria esclarecer o que eu estava com duvida para ver se entendi:
Primeira pergunta: a logica seria usarmos a velocidade media ao quadrado , certo? Porem por ser de dificil calculo, utiliza-se a velocidade media quadratica, que e proxima da velocidade media ao quadrado, correto?
Segunda pergunta: Para a minha apostila (que nao usou a notacao com traco, podemos dizer que ela considerou que a velocidade de uma so particula nas tres dimensoes seria a velocidade media, que por sua vez no Topicos foi usado como sendo a velocidade media quadratica , estou correta?
ENFIM, SERIO AGRADECO MUITOOOO DESDE JA !!
Maria Pietra Negrão- Padawan

- Mensagens : 86
Data de inscrição : 19/11/2020
 Re: Cinetica dos Gases
Re: Cinetica dos Gases
Maria Pietra Negrão escreveu:Emanuel, eu novamente... hahha
Primeiro queria agradecer , segundo queria esclarecer o que eu estava com duvida para ver se entendi:
Primeira pergunta: a logica seria usarmos a velocidade media ao quadrado , certo? Porem por ser de dificil calculo, utiliza-se a velocidade media quadratica, que e proxima da velocidade media ao quadrado, correto?
Segunda pergunta: Para a minha apostila (que nao usou a notacao com traco, podemos dizer que ela considerou que a velocidade de uma so particula nas tres dimensoes seria a velocidade media, que por sua vez no Topicos foi usado como sendo a velocidade media quadratica , estou correta?
ENFIM, SERIO AGRADECO MUITOOOO DESDE JA !!
Quase isso Maria. Vamos por parte.
Vamos imaginar que nós dois vivamos no século 18, antes do desenvolvimento da Termodinâmica estatística.
Grandes nomes da ciência como Coriolis, Lorde Kelvin, Émilie du Châtelet, e muitos outros que contribuíram para mecânica dos sólidos nos ensinaram que a energia cinética de um ponto material de massa m é matematicamente descrito pela expressão E=mv²/2, onde v é a velocidade em um dado referencial.
Veja bem a parte em negrito, ela é muito importante.
Então, até aqui, sabemos calcular a energia cinética de um ponto, a mecânica de sólidos ia muito bem.
Mas e se estivermos trabalhando com corpos rígidos de dimensões não redutíveis a um ponto? No fundo é isso que se trata um gás, é um conjunto "infinito" de partículas pontuais. Sabemos que o número de partículas é tão grande, que é impossível calcular Ec do modo tradicional como sabemos até agora, então teremos que ser criativos e desenvolver uma ideia nova.
Surgiu assim a Termodinâmica estatística. Estatística porque vamos fazer aproximações.
Não precisamos ser 100% preciso para usarmos nossa teoria, a Relatividade é mais precisa que a mecânica newtoniana e todo prédio e casa que é erguido é com base na mecânica newtoniana.
Então, para desenvolver a teoria, vamos usar o método científico. Vamos usar os dados que a gente tem para explicar um fenômeno e tentar prever outros.
O dado mais importante que temos na época do surgimento do campo de estudo é o trabalho de J. C. Maxwell.
O que Maxwell nos ensinou é que um gás é muito dependente da natureza probabilística. Vamos ver o que isso significa:

Primeira coisa ao olhar para o gif vamos nos questionar: será que todas as partículas possuem mesma velocidade? Perfeitamente iguais? Ou será que umas são mais rápidas que as outras? Veja como tem partículas que quase ficam paradas por um tempo.
Maxwell, empiricamente descobriu que a velocidade das moléculas de um gás não são iguais, na verdade podem ser tão diferente que chega a assustar.
Seus estudos nos dizem o seguinte: a velocidade das moléculas em um gás estão em um intervalo. Isso significa que elas não são iguais. Esse intervalo é bem grande, é fácil explicar isso, a colisão incessante de partículas pode fazer uma ser mais rápida que a outra.
Vamos pegar como exemplo um gás hidrogênio que contém apenas 3 moléculas, como aprendemos com trabalho do Maxwell a velocidade delas não são necessariamente iguais.
Vamos supor que uma está quase-estática e as outras se movem com velocidade v1 e v2. Qual será a energia cinética do gás?
Pela mecânica convencional, a energia cinética do gás será: [latex]Ec=\frac{mv_1^2}{2}+\frac{mv_2^2}{2}+\frac{m0}{2}[/latex]
mas, como Maxwell mostrou, as velocidades das moléculas estão em um intervalo muito grande, varia de 0 a 800 m/s por exemplo. Então, a energia cinética do gás, seria a soma da energia cinética de cada molécula. As moléculas que tem velocidade nula não contribuem para a energia cinética do gás, as que tem velocidade intermediária, contribuem um pouco, as que tem velocidade altíssima contribuem muito. Para evitar o trabalho matemático, podemos aproximar dizendo que todas as moléculas tem uma velocidade bem definida e igual, em vez de ter moléculas com velocidade variando, podemos impor que todas elas tenham a mesma velocidade. A questão é, vamos fazer isso apenas impondo uma coisa:
ainda para o exemplo do gás com 3 moléculas:
[latex]Ec=\frac{mv_1^2}{2}+\frac{mv_2^2}{2}+\frac{m0}{2}[/latex] essa é a energia cinética para o gás real, matematicamente complicado de mais para trabalhar.
[latex]Ec'=\frac{m\overline{v}^2}{2}+\frac{m\overline{v}^2}{2}+\frac{m\overline{v}^2}{2}[/latex] essa é a energia cinética que o nosso modelo vai fornecer, a condição que vamos impor é que esse modelo simplificado seja o mais próximo da realidade possível:
[latex]\frac{m\overline{v}^2}{2}+\frac{m\overline{v}^2}{2}+\frac{m\overline{v}^2}{2}=\frac{mv_1^2}{2}+\frac{mv_2^2}{2}+\frac{m0}{2}[/latex]
Está entendendo ou estou complicando muito?
v traço é uma velocidade que está acima de 0 e abaixo da velocidade da partícula mais rápida, mas que no fim aproxima-se muito da real energia cinética do gás.
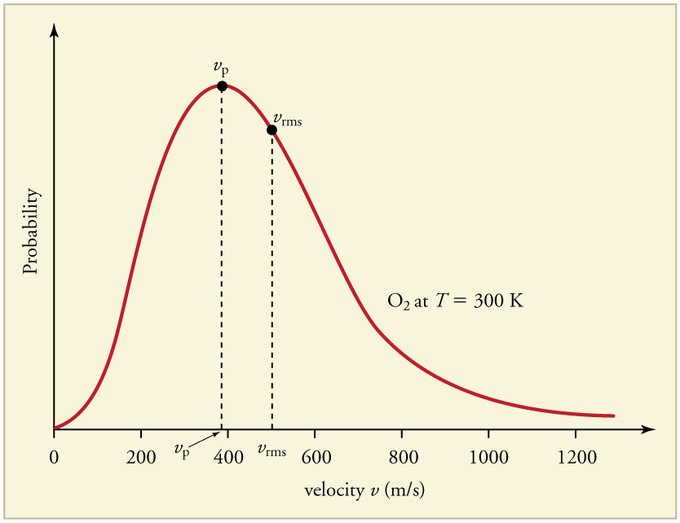
Olhe um gráfico dessa distribuição, veja que a velocidade das moléculas do gás O2 varia desde 0 a 1200 m/s, mas, usando a matemática, podemos encontrar a velocidade média quadrática, que no gráfico é representada por vrms. Ela é a média desse gráfico, para obter essa média do modo formal, usamos o o cálculo integral, por isso não tem nada haver com média que estamos acostumado no ensino médio.
O que podemos dizer da velocidade média quadrática é que é a
raiz quadrada da média aritmética do quadrado das velocidades das moléculas
, diferente da velocidade média.Quanto a apostila. ela usou a velocidade média quadrática, só não usou a notação.
Não sei se eu compliquei de mais, se ainda ficou complicado pode continuar perguntando até eu conseguir ou alguém aqui do fórum conseguir tirar sua dúvida.
____________________________________________
El Álgebra no es más que Geometría y la Geometría no es más que Álgebra abstracta
Sophie Germain
Sophie Germain
Emanuel Dias- Monitor

- Mensagens : 1703
Data de inscrição : 15/12/2018
Idade : 22
Localização : São Paulo
Maria Pietra Negrão gosta desta mensagem
Página 1 de 2 • 1, 2 
 Tópicos semelhantes
Tópicos semelhantes» Cinética dos Gases
» Cinética dos Gases
» (UPE) A teoria cinética dos gases é uma boa a
» [Cinética dos gases]
» Teoria Cinética dos Gases.
» Cinética dos Gases
» (UPE) A teoria cinética dos gases é uma boa a
» [Cinética dos gases]
» Teoria Cinética dos Gases.
PiR2 :: Física :: Termologia
Página 1 de 2
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|
















