Cinética Química
2 participantes
PiR2 :: Química :: Físico-Química
Página 1 de 1
 Cinética Química
Cinética Química
Magnésio interage com ácidos segundo a equação:
Mg(s) + 2 H+(aq) → Mg2+(aq) + H2(g)
Para o estudo dessa reação, duas experiências foram realizadas, tendo-se usado massas iguais de magnésio e volumes iguais de HCℓ 1,0 mol/L e CH3COOH 1,0 mol/L. Os volumes de hidrogênio liberado foram medidos a cada 30 s. Os resultados foram projetados em gráfico, como se mostra a seguir.
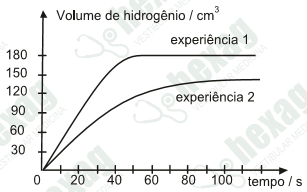
Das afirmações feitas sobre esse estudo, todas estão corretas, exceto uma. Assinale-a.
a) A rapidez de liberação de H2 foi maior na experiência 1 do que na 2.
b) Na solução ácida usada na experiência 1 havia maior concentração de íons H+.
c) O ácido utilizado na experiência 1 foi CH3COOH 1,0 mol/L.
d) Pode-se estimar que na experiência 1 todo o magnésio foi consumido ao fim de 55 s, aproximadamente.
e) Pode-se estimar que, em ambas as experiências, o volume total de H2 liberado foi 150 cm3, embora em tempos diferentes.
Gabarito: C
Eu gostaria que alguém comentasse as afirmativas
Mg(s) + 2 H+(aq) → Mg2+(aq) + H2(g)
Para o estudo dessa reação, duas experiências foram realizadas, tendo-se usado massas iguais de magnésio e volumes iguais de HCℓ 1,0 mol/L e CH3COOH 1,0 mol/L. Os volumes de hidrogênio liberado foram medidos a cada 30 s. Os resultados foram projetados em gráfico, como se mostra a seguir.

Das afirmações feitas sobre esse estudo, todas estão corretas, exceto uma. Assinale-a.
a) A rapidez de liberação de H2 foi maior na experiência 1 do que na 2.
b) Na solução ácida usada na experiência 1 havia maior concentração de íons H+.
c) O ácido utilizado na experiência 1 foi CH3COOH 1,0 mol/L.
d) Pode-se estimar que na experiência 1 todo o magnésio foi consumido ao fim de 55 s, aproximadamente.
e) Pode-se estimar que, em ambas as experiências, o volume total de H2 liberado foi 150 cm3, embora em tempos diferentes.
Gabarito: C
Eu gostaria que alguém comentasse as afirmativas

Hévila Farias- Jedi

- Mensagens : 210
Data de inscrição : 20/11/2015
Idade : 26
Localização : Duque de Caxias, Rio de Janeiro - Brasil

Orihara- Mestre Jedi

- Mensagens : 699
Data de inscrição : 18/09/2014
Idade : 29
Localização : Santa Catarina
PiR2 :: Química :: Físico-Química
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












