Aumentar o número de colisões moleculares
2 participantes
PiR2 :: Física :: Termologia
Página 1 de 1
 Aumentar o número de colisões moleculares
Aumentar o número de colisões moleculares
Descreva três possíveis formas efetivas de aumentar o número de colisões moleculares por unidade de tempo em um gás ideal. Justifique suas escolhas com base na Teoria Cinética dos Gases.
(Tenho prova de física e o professor passa uma lista para estudar, na prova ele geralmente cobra algumas questões da lista, então seria bom entender bem essa, se alguém puder explicar bem agradeço.)
(Tenho prova de física e o professor passa uma lista para estudar, na prova ele geralmente cobra algumas questões da lista, então seria bom entender bem essa, se alguém puder explicar bem agradeço.)
leilaap- Iniciante
- Mensagens : 14
Data de inscrição : 23/01/2017
Idade : 27
Localização : São Carlos - SP - Brasil
 Re: Aumentar o número de colisões moleculares
Re: Aumentar o número de colisões moleculares
Sabemos que o número de colisões moleculares e com as paredes do recipiente é diretamente proporcional ao estado de agitação térmica das partículas situadas no sistema, estado esse que é função exclusiva da energia cinética das moléculas. Três possíveis formas efetivas de se aumentar esse número de colisões são:
1) Fornecer calor ao sistema de tal forma que ele não dissipe essa energia para o meio externo. Com isso, todo o calor absorvido pelas moléculas será convertido integralmente em energia interna do sistema, aumentado portanto a energia cinética média das partículas.
2) Aumentarmos a pressão do sistema. Com isso e supondo constante a massa específica gasosa com a temperatura, aumentamos a velocidade média das partículas do gás o que consequentemente aumenta a energia cinética média das partículas: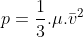
3) Aumentarmos a temperatura do sistema, com a equação à análise é imediata. Segundo a Lei de Joule: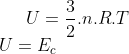
1) Fornecer calor ao sistema de tal forma que ele não dissipe essa energia para o meio externo. Com isso, todo o calor absorvido pelas moléculas será convertido integralmente em energia interna do sistema, aumentado portanto a energia cinética média das partículas.
2) Aumentarmos a pressão do sistema. Com isso e supondo constante a massa específica gasosa com a temperatura, aumentamos a velocidade média das partículas do gás o que consequentemente aumenta a energia cinética média das partículas:
3) Aumentarmos a temperatura do sistema, com a equação à análise é imediata. Segundo a Lei de Joule:

Willian Honorio- Matador

- Mensagens : 1271
Data de inscrição : 27/04/2016
Idade : 27
Localização : São Paulo
 Tópicos semelhantes
Tópicos semelhantes» Aumentar a produção de SO3
» Aumentar eficiência
» Aumentar concentração
» Aumentar sua contribuição em
» É possível aumentar 100 pontos no ENEM?
» Aumentar eficiência
» Aumentar concentração
» Aumentar sua contribuição em
» É possível aumentar 100 pontos no ENEM?
PiR2 :: Física :: Termologia
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












