Tabela periódica - Questão UFMG
2 participantes
Página 1 de 1
 Tabela periódica - Questão UFMG
Tabela periódica - Questão UFMG
(UFMG) Observe o desenho que mostra
representações em escala de algumas espécies
químicas monoatômicas:
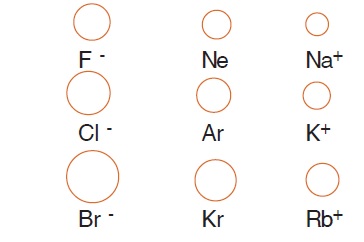
Indique a alternativa que apresenta informações
corretas com relação às causas da variação
dos raios das espécies.
a) O raio de Br- é maior do que o de Kr e o de
Rb+, porque Br- é a espécie que tem mais
camadas eletrônicas ocupadas.
b) O raio de Cl- é maior do que o de Ar e o de K+,
porque o núcleo de Cl- é o de menor carga
positiva.
c) O raio de F- é maior do que o de Ne e o de
Na+, porque F - é a espécie que tem menos
elétrons.
d) O raio de F- é menor do que o de Cl- e o de Br,
porque F- é a espécie com núcleo de menor
raio.
e) O raio de Ne é menor do que o de Ar e o de Kr,
porque Ne tem a menor repulsão entre os
elétrons da última camada.
O gabarito da questão é a letra B
*Por favor, expliquem-me o porque das demais alternativas estarem erradas e a B estar correta. Estou me confundindo em relação aos itens.
representações em escala de algumas espécies
químicas monoatômicas:

Indique a alternativa que apresenta informações
corretas com relação às causas da variação
dos raios das espécies.
a) O raio de Br- é maior do que o de Kr e o de
Rb+, porque Br- é a espécie que tem mais
camadas eletrônicas ocupadas.
b) O raio de Cl- é maior do que o de Ar e o de K+,
porque o núcleo de Cl- é o de menor carga
positiva.
c) O raio de F- é maior do que o de Ne e o de
Na+, porque F - é a espécie que tem menos
elétrons.
d) O raio de F- é menor do que o de Cl- e o de Br,
porque F- é a espécie com núcleo de menor
raio.
e) O raio de Ne é menor do que o de Ar e o de Kr,
porque Ne tem a menor repulsão entre os
elétrons da última camada.
O gabarito da questão é a letra B
*Por favor, expliquem-me o porque das demais alternativas estarem erradas e a B estar correta. Estou me confundindo em relação aos itens.

lostbutwon- Iniciante
- Mensagens : 23
Data de inscrição : 12/04/2015
Idade : 26
Localização : Campos dos Goytacazes, Rio de Janeiro, Brasil
 Re: Tabela periódica - Questão UFMG
Re: Tabela periódica - Questão UFMG
Imagem da questão: https://2img.net/h/s10.postimg.cc/z6261f2m1/image.jpg

lostbutwon- Iniciante
- Mensagens : 23
Data de inscrição : 12/04/2015
Idade : 26
Localização : Campos dos Goytacazes, Rio de Janeiro, Brasil
 Re: Tabela periódica - Questão UFMG
Re: Tabela periódica - Questão UFMG
É só você observar a posição dos elementos na tabela periódica.
a) O raio de Br- é maior do que o de Kr e o de
Rb+, porque Br- é a espécie que tem mais
camadas eletrônicas ocupadas.
Errado. O Br- tem o mesmo número de camadas que o Kr e o Rb+. O que o faz ser maior é o aumento de um elétron. Aliás, ânions são sempre maiores em relação ao átomo original.
b) O raio de Cl- é maior do que o de Ar e o de K+,
porque o núcleo de Cl- é o de menor carga
positiva.
Certo. O ânion Cl- teve aumento de um elétron, mas conservou o núcleo do átomo original(Z17), que tem menos prótons que o Ar(Z18) e o K+(Z19).
c) O raio de F- é maior do que o de Ne e o de
Na+, porque F - é a espécie que tem menos
elétrons.
Errado, os três tem a mesma quantidade de elétrons (isoeletrônicos).
d) O raio de F- é menor do que o de Cl- e o de Br-,
porque F- é a espécie com núcleo de menor
raio.
Errado. O F-, de fato, é o de menor raio, mas o que faz isso acontecer é a adição de uma camada eletrônica do F- para o CL- e de duas do F- para o Br-, ou seja, não se mede o raio atômico apenas pelo núcleo, deve-se levar em consideração todo o átomo (núcleo-eletrosfera)
e) O raio de Ne é menor do que o de Ar e o de Kr,
porque Ne tem a menor repulsão entre os
elétrons da última camada.
Errado. Novamente, a primeira parte está certa, o raio do Ne é o menor, entretanto a repulsão dos elétrons é a mesma. O que provoca o aumento dos raios do Ar e Kr é a adição de camadas eletrônicas.
a) O raio de Br- é maior do que o de Kr e o de
Rb+, porque Br- é a espécie que tem mais
camadas eletrônicas ocupadas.
Errado. O Br- tem o mesmo número de camadas que o Kr e o Rb+. O que o faz ser maior é o aumento de um elétron. Aliás, ânions são sempre maiores em relação ao átomo original.
b) O raio de Cl- é maior do que o de Ar e o de K+,
porque o núcleo de Cl- é o de menor carga
positiva.
Certo. O ânion Cl- teve aumento de um elétron, mas conservou o núcleo do átomo original(Z17), que tem menos prótons que o Ar(Z18) e o K+(Z19).
c) O raio de F- é maior do que o de Ne e o de
Na+, porque F - é a espécie que tem menos
elétrons.
Errado, os três tem a mesma quantidade de elétrons (isoeletrônicos).
d) O raio de F- é menor do que o de Cl- e o de Br-,
porque F- é a espécie com núcleo de menor
raio.
Errado. O F-, de fato, é o de menor raio, mas o que faz isso acontecer é a adição de uma camada eletrônica do F- para o CL- e de duas do F- para o Br-, ou seja, não se mede o raio atômico apenas pelo núcleo, deve-se levar em consideração todo o átomo (núcleo-eletrosfera)
e) O raio de Ne é menor do que o de Ar e o de Kr,
porque Ne tem a menor repulsão entre os
elétrons da última camada.
Errado. Novamente, a primeira parte está certa, o raio do Ne é o menor, entretanto a repulsão dos elétrons é a mesma. O que provoca o aumento dos raios do Ar e Kr é a adição de camadas eletrônicas.

wmsj- Recebeu o sabre de luz

- Mensagens : 118
Data de inscrição : 01/12/2013
Idade : 28
Localização : Campo Grande
 Re: Tabela periódica - Questão UFMG
Re: Tabela periódica - Questão UFMG
Agora consegui finalmente entender. É só saber interpretar a tabela periódica mesmo com cuidado. Obrigado!

lostbutwon- Iniciante
- Mensagens : 23
Data de inscrição : 12/04/2015
Idade : 26
Localização : Campos dos Goytacazes, Rio de Janeiro, Brasil
 Tópicos semelhantes
Tópicos semelhantes» Questão de tabela periódica
» Questão Tabela periodica dos Elementos
» Questão Tabela periodica dos Elementos
» Questão sobre Tabela Periódica.
» questao envolvendo tabela periodica
» Questão Tabela periodica dos Elementos
» Questão Tabela periodica dos Elementos
» Questão sobre Tabela Periódica.
» questao envolvendo tabela periodica
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












