Reatividade
2 participantes
Página 1 de 1
 Reatividade
Reatividade
Olá! Estou em dúvida quanto a ordem de reatividade dos metais e ametais, porque, quanto mais pesquiso, mais confuso fica. Se puderem confirmar se estou certa ou me corrigir, agradeço!
Metais: 1A e 2A são os mais reativos e os metais nobres, os menos.
Ametais: F é o mais reativo e S, o menos.
Metais: 1A e 2A são os mais reativos e os metais nobres, os menos.
Ametais: F é o mais reativo e S, o menos.
Última edição por fernandalnh em Qua 14 Abr 2021, 18:38, editado 1 vez(es)

fernandalnh- Recebeu o sabre de luz

- Mensagens : 132
Data de inscrição : 02/02/2021
Idade : 21
Localização : Macapá, AP
 Re: Reatividade
Re: Reatividade
Olá Fernanda!
Boa tarde!
Sim, vc está quase correta... Mas vamos analisar umas coisas:
Existe um artifício criado chamada Ordem de Reatividade! Ela é, basicamente falando, uma linha reta escrita mostrando a ordem decrescente de reatividade, tanto dos metais quanto dos ametais, e usaremos ela para te responder!
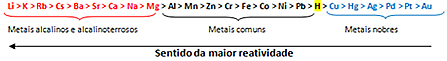
Essa dai representa a Fila de Reatividade dos Metais! Olhe e observe que as Famílias 1A e 2A são logo as primeiras, depois vemos os Metais Comuns e logo no final temos os Metais Nobres. Analisando, percebemos que o metal mais reativo é o Lítio(Li) e o metal menos reativo é o Ouro(Au). Essa daqui é a Fila de Reatividade dos Ametais, e observe que o ametal mais reativo é o Flúor(F) e o ametal menos reativo é o Carbono(C).
Tem uma regrinha bem legal pra decorar essa fila, olha só
Agora, observe essa daqui:
F > O > N > Cl > Br > I > S > C > P > H
Essa daqui é a Fila de Reatividade dos Ametais, e observe que o ametal mais reativo é o Flúor(F) e o ametal menos reativo é o Carbono(C).
“Fui Ontem No Clube, Briguei I Saí Correndo Para o Hospital”.
Espero que tenha ficado claro pra vc, qualquer dúvida não deixe de pontuar! Abraços!
Boa tarde!
Sim, vc está quase correta... Mas vamos analisar umas coisas:
Existe um artifício criado chamada Ordem de Reatividade! Ela é, basicamente falando, uma linha reta escrita mostrando a ordem decrescente de reatividade, tanto dos metais quanto dos ametais, e usaremos ela para te responder!

Essa dai representa a Fila de Reatividade dos Metais! Olhe e observe que as Famílias 1A e 2A são logo as primeiras, depois vemos os Metais Comuns e logo no final temos os Metais Nobres. Analisando, percebemos que o metal mais reativo é o Lítio(Li) e o metal menos reativo é o Ouro(Au). Essa daqui é a Fila de Reatividade dos Ametais, e observe que o ametal mais reativo é o Flúor(F) e o ametal menos reativo é o Carbono(C).
Tem uma regrinha bem legal pra decorar essa fila, olha só
Agora, observe essa daqui:
F > O > N > Cl > Br > I > S > C > P > H
Essa daqui é a Fila de Reatividade dos Ametais, e observe que o ametal mais reativo é o Flúor(F) e o ametal menos reativo é o Carbono(C).
Tem uma regrinha bem legal pra decorar essa fila, olha só:
“Fui Ontem No Clube, Briguei I Saí Correndo Para o Hospital”.
Espero que tenha ficado claro pra vc, qualquer dúvida não deixe de pontuar! Abraços!

BatataLaranja345- Mestre Jedi

- Mensagens : 669
Data de inscrição : 09/07/2020
Idade : 19
Localização : Rio de Janeiro
fernandalnh gosta desta mensagem
 Re: Reatividade
Re: Reatividade
Obrigada!! Você pode me tirar mais uma dúvida, por favor? Eu estava vendo uma questão que analisava a reatividade entre íons e os elementos mais reativos ficaram ao contrário dessas ordens que você apresentou.
Qual raciocínio eu preciso ter quando se trata da reatividade de íons, então?
Qual raciocínio eu preciso ter quando se trata da reatividade de íons, então?

fernandalnh- Recebeu o sabre de luz

- Mensagens : 132
Data de inscrição : 02/02/2021
Idade : 21
Localização : Macapá, AP
BatataLaranja345 gosta desta mensagem
 Re: Reatividade
Re: Reatividade
Bom, vamos pensar no seguinte:
Na Fila de Reatividade dos Metais, temos que aqueles mais reativos tendem mais eletropositividade, logo, eles apresentam íons positivos com mais frequência devido a eles perderem elétrons de forma bem fácil.
Já na Fila de Reatividade dos Ametais, temos que eles serão mais reativos conforme eles se apresentam mais eletronegativos, tendendo a ganhar elétrons e apresentar íons negativos.
Ou seja, os metais mais reativos formam íons positivos, devido a sua facilidade de perder elétrons. Logo, por exemplo, o Potássio(K) tem grande potêncial de perder elétrons, pois ele é bem reativo. Porém, os ametais mais reativos forma íons negativos, devido a sua facilidade de ganhar elétrons; logo, podemos pensar no Flúor(F), que é o elemento mais eletronegativo da tabela!
Ficou claro? Qualquer dúvida, pode postar! Abraços!
Na Fila de Reatividade dos Metais, temos que aqueles mais reativos tendem mais eletropositividade, logo, eles apresentam íons positivos com mais frequência devido a eles perderem elétrons de forma bem fácil.
Já na Fila de Reatividade dos Ametais, temos que eles serão mais reativos conforme eles se apresentam mais eletronegativos, tendendo a ganhar elétrons e apresentar íons negativos.
Ou seja, os metais mais reativos formam íons positivos, devido a sua facilidade de perder elétrons. Logo, por exemplo, o Potássio(K) tem grande potêncial de perder elétrons, pois ele é bem reativo. Porém, os ametais mais reativos forma íons negativos, devido a sua facilidade de ganhar elétrons; logo, podemos pensar no Flúor(F), que é o elemento mais eletronegativo da tabela!
Ficou claro? Qualquer dúvida, pode postar! Abraços!

BatataLaranja345- Mestre Jedi

- Mensagens : 669
Data de inscrição : 09/07/2020
Idade : 19
Localização : Rio de Janeiro
fernandalnh gosta desta mensagem
 Re: Reatividade
Re: Reatividade
Ficou claro o que você explicou, mas a dúvida prevalece haha. Vou exemplificar: segundo a ordem de reatividade, o cloro é mais reativo que o bromo, certo? No entanto, na questão a qual me refiro, o ânion bromo passa a ser mais reativo do que o cloreto. Por que isso acontece?
Obrigada por sanar mais uma dúvida! Abraços!
Obrigada por sanar mais uma dúvida! Abraços!

fernandalnh- Recebeu o sabre de luz

- Mensagens : 132
Data de inscrição : 02/02/2021
Idade : 21
Localização : Macapá, AP
BatataLaranja345 gosta desta mensagem
 Re: Reatividade
Re: Reatividade
Então, Fernanda...
Realmente uma dúvida muito boa a sua kkkkk
Mas não tenho certeza da minha explicação de agora.
Realmente, é um caso bem curioso pq, analisando o Cl(-1) e o Br(-1), ambos completaram o octeto. Tendo que eles apresentam 8 elétrons na camada de valência.
E a nossa fila de reatividade apresenta eles com base na eletronegatividade. Então, após os íons serem formados, eles estariam estáveis. Porém, temos o seguinte problema, os elétrons a mais presentes nos átomos dos íons não são deles(e não nos perguntamos do pq deles estarem lá, a não ser q a questão diga do pq), logo, isso pode apresentar certa instabilidade nuclear...
Portanto, eles começam a apresentar uma tendência a perder esse elétron, e quem perde primeiro seria o Bromo, pois sua capacidade de eletropositividade é maior do que a do Cloro. Veja essa foto:

Nela, mostra isso!
Lembrando que não tenho certeza disso, pois o motivo desse fenômeno ocorrer pode ser derivado de um assunto mais avançado. Logo, tentei explicar com base nessas ideias do átomo, mesmo sendo um íon, de ganhar ou perder elétrons!
Espero que tenha te ajudado, e não confundido ainda mais vc kkkkk!
Abraços!
Realmente uma dúvida muito boa a sua kkkkk
Mas não tenho certeza da minha explicação de agora.
Realmente, é um caso bem curioso pq, analisando o Cl(-1) e o Br(-1), ambos completaram o octeto. Tendo que eles apresentam 8 elétrons na camada de valência.
E a nossa fila de reatividade apresenta eles com base na eletronegatividade. Então, após os íons serem formados, eles estariam estáveis. Porém, temos o seguinte problema, os elétrons a mais presentes nos átomos dos íons não são deles(e não nos perguntamos do pq deles estarem lá, a não ser q a questão diga do pq), logo, isso pode apresentar certa instabilidade nuclear...
Portanto, eles começam a apresentar uma tendência a perder esse elétron, e quem perde primeiro seria o Bromo, pois sua capacidade de eletropositividade é maior do que a do Cloro. Veja essa foto:

Nela, mostra isso!
Lembrando que não tenho certeza disso, pois o motivo desse fenômeno ocorrer pode ser derivado de um assunto mais avançado. Logo, tentei explicar com base nessas ideias do átomo, mesmo sendo um íon, de ganhar ou perder elétrons!
Espero que tenha te ajudado, e não confundido ainda mais vc kkkkk!
Abraços!

BatataLaranja345- Mestre Jedi

- Mensagens : 669
Data de inscrição : 09/07/2020
Idade : 19
Localização : Rio de Janeiro
fernandalnh gosta desta mensagem
 Re: Reatividade
Re: Reatividade
Ah, mas isso fez muito sentido pra mim! Ora, se o cloro é mais eletronegativo, a tendência de "soltar" o elétron realmente será maior pelo elemento mais eletropositivo.
Muito obrigada pela paciência haha!
Abraços!
Muito obrigada pela paciência haha!

Abraços!

fernandalnh- Recebeu o sabre de luz

- Mensagens : 132
Data de inscrição : 02/02/2021
Idade : 21
Localização : Macapá, AP
BatataLaranja345 gosta desta mensagem
 Re: Reatividade
Re: Reatividade
Ufa! kkkkkkk que bom q ficou claro no final!
Um tema bem confuso às vezes é esse, tem q ser feito com muito cuidado, pq senão ele gera um monte de dúvidas mesmo!
Mas fico feliz que no final vc conseguiu entender!
Abraços!
Um tema bem confuso às vezes é esse, tem q ser feito com muito cuidado, pq senão ele gera um monte de dúvidas mesmo!
Mas fico feliz que no final vc conseguiu entender!
Abraços!

BatataLaranja345- Mestre Jedi

- Mensagens : 669
Data de inscrição : 09/07/2020
Idade : 19
Localização : Rio de Janeiro
fernandalnh gosta desta mensagem
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|














